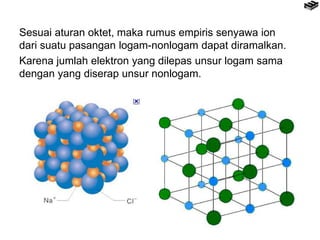
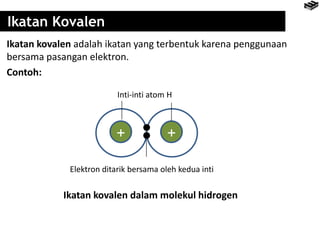
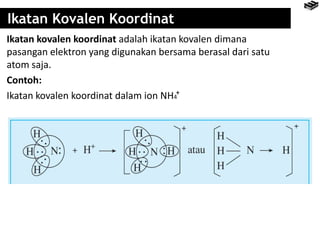
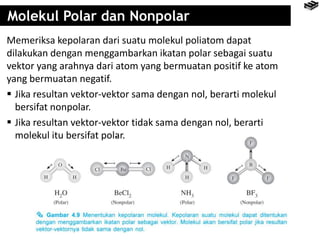
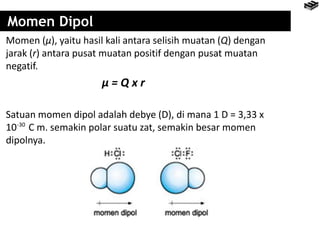
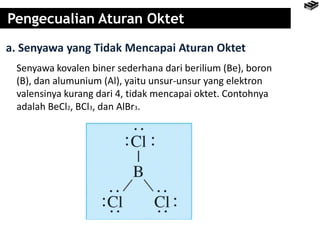
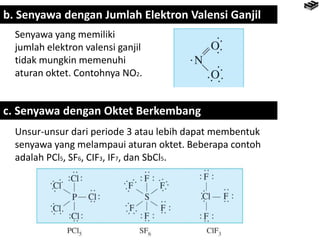
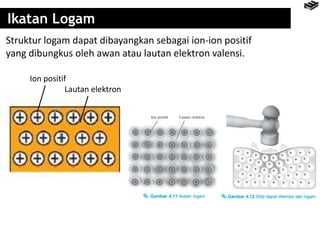
Bab 4 membahas berbagai jenis ikatan kimia seperti ikatan ion, kovalen, logam, dan pengecualian aturan oktet. Ikatan terbentuk karena interaksi elektron antaratom untuk mencapai konfigurasi elektron seperti gas mulia. Rumus senyawa dapat diramalkan berdasarkan jumlah elektron yang dilepas dan diserap untuk mencapai konfigurasi oktet.