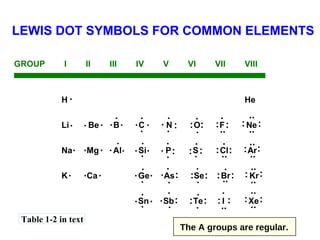
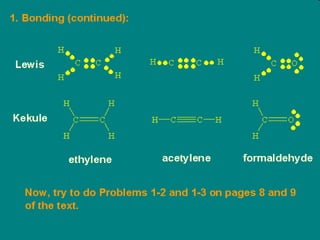
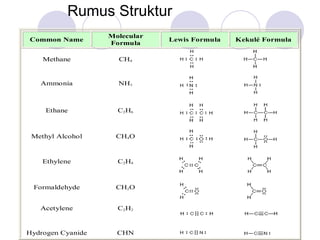
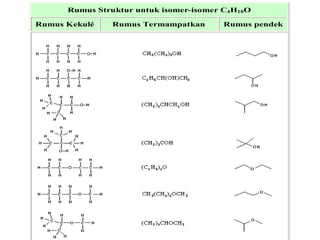
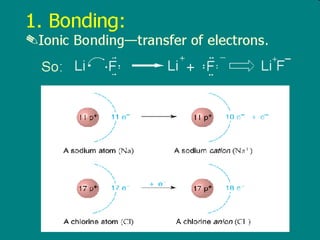
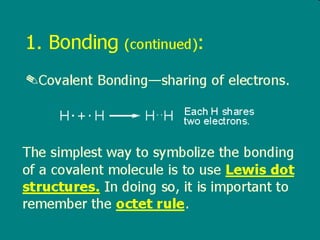
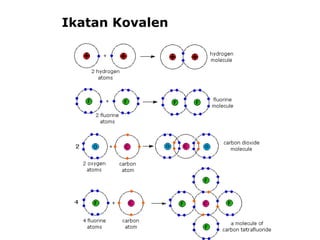
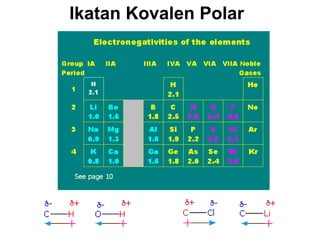
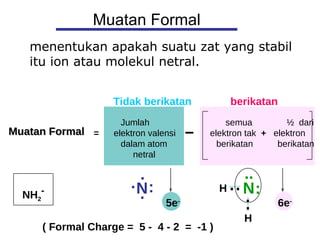
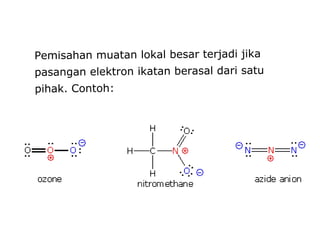
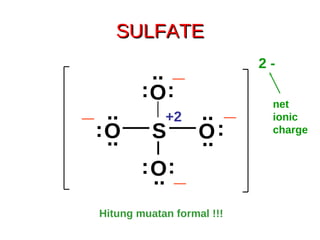
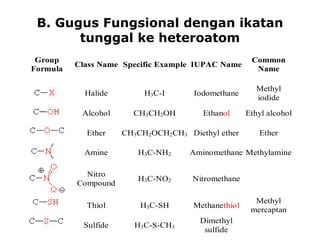
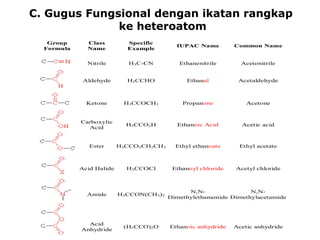
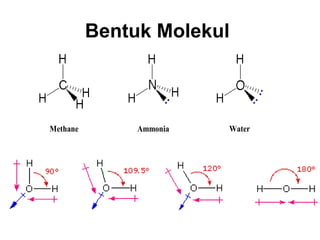
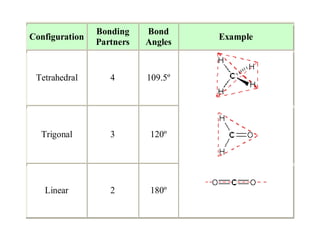
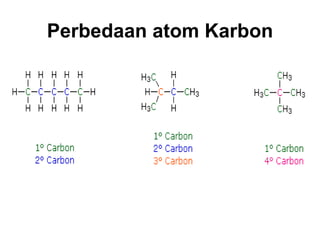
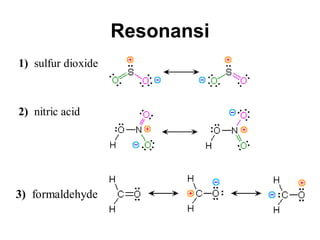
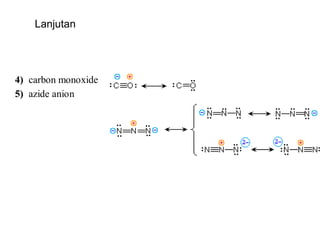
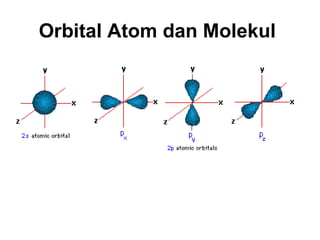
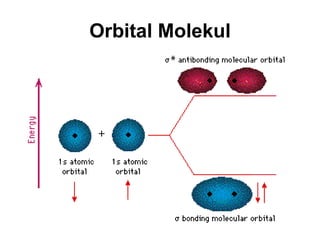
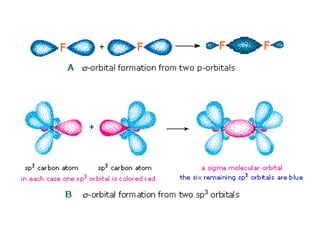
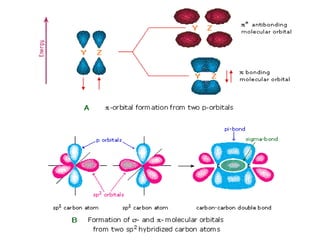
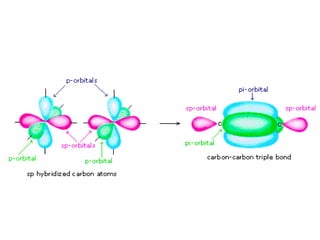
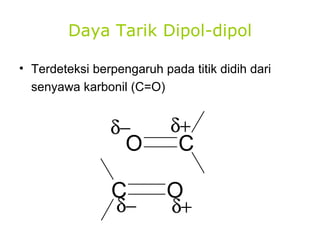
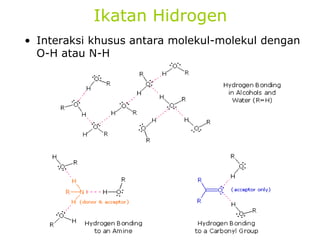
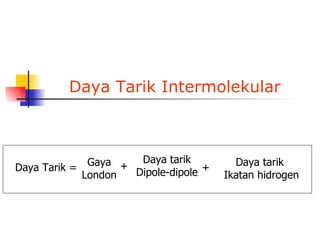
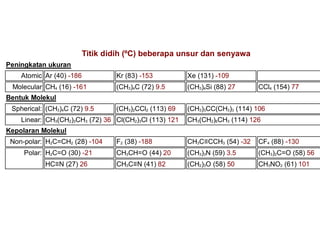
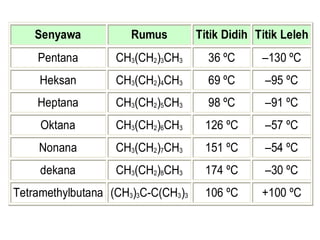
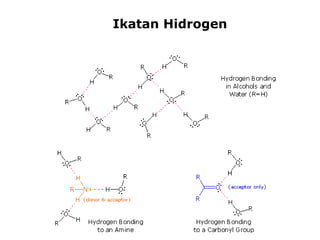
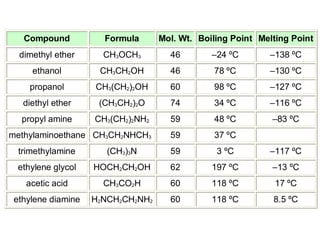
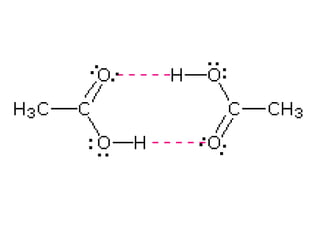
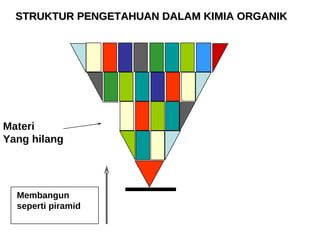
1) Dokumen memberikan pedoman untuk belajar kimia organik yang efektif, termasuk menghadiri kelas, bertanya, membuat catatan, mengerjakan tugas, berlatih soal, dan mempelajari cara mengerjakan ujian dengan baik. 2) Dokumen menjelaskan struktur pengetahuan kimia organik seperti piramida di mana materi yang hilang dapat menyebabkan keruntuhan struktur. 3) Dokumen menjelaskan beberapa konsep dasar k




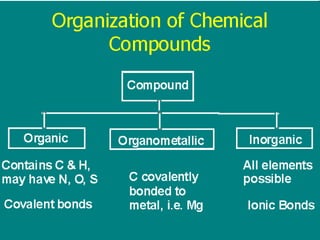




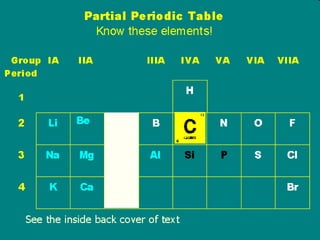
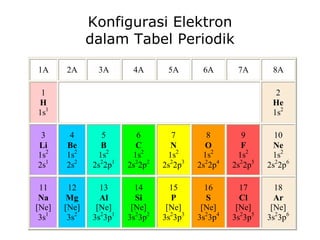
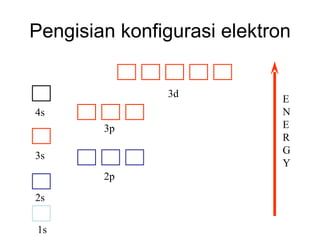
![Konfigurasi Elektron 11 unsur pertama H 1 1s 1 [CORE] VALENCE SHELL He 2 1s 2 Li 3 1s 2 2s 1 [1s 2 ]2s 1 Be 4 1s 2 2s 2 [1s 2 ]2s 2 B 5 1s 2 2s 2 2p 1 [1s 2 ]2s 2 2p x 1 C 6 1s 2 2s 2 2p 2 [1s 2 ]2s 2 2p x 1 2p y 1 N 7 1s 2 2s 2 2p 3 O 8 1s 2 2s 2 2p 4 F 9 1s 2 2s 2 2p 5 Ne 10 1s 2 2s 2 2p 6 Na 11 1s 2 2s 2 2p 6 3s 1 [1s 2 2s 2 2p 6 ]3s 1](https://image.slidesharecdn.com/babikoi-090903002835-phpapp02/85/Struktur-Molekul-Organik-14-320.jpg)



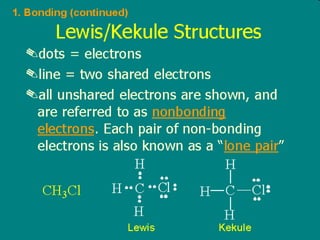
![SImbol Bulir LEWIS Be [1s 2 ] 2s 2 Be . . Inti Elektron Valensi](https://image.slidesharecdn.com/babikoi-090903002835-phpapp02/85/Struktur-Molekul-Organik-19-320.jpg)