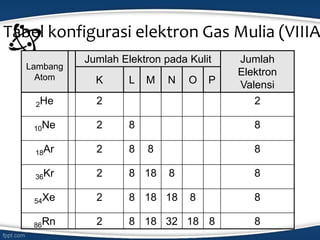
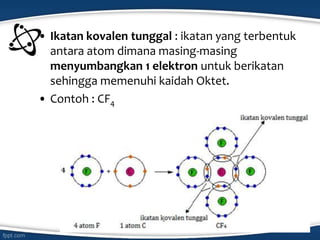
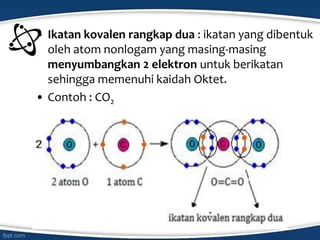
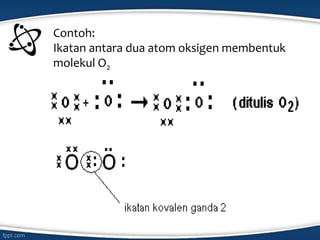
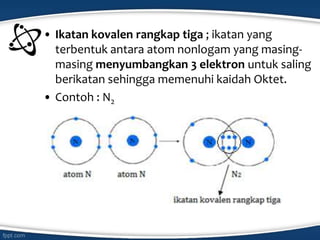
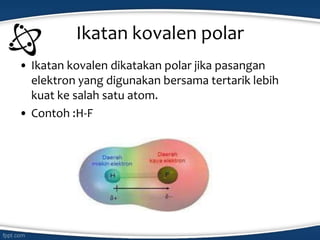
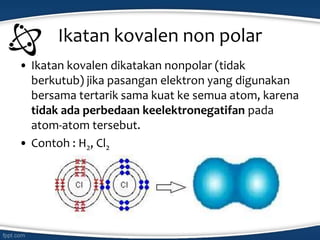
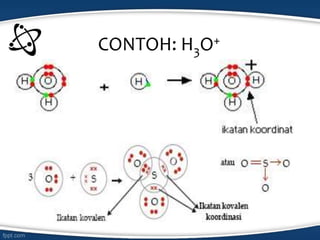
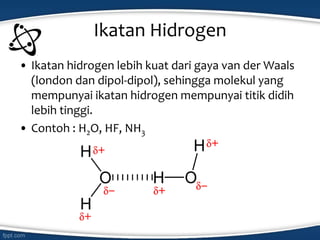
Dokumen tersebut membahas konsep ikatan kimia dan jenis-jenis ikatan kimia seperti ikatan ion, kovalen, koordinasi, dan hidrogen. Ikatan kimia terjadi karena interaksi elektron antar atom untuk mencapai stabilisasi. Jenis ikatan tergantung pada sifat kimia unsur dan kecenderungannya untuk melepas atau menangkap elektron.