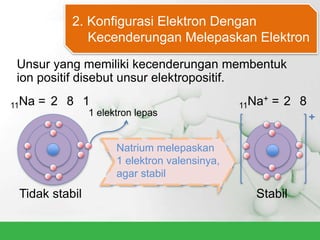
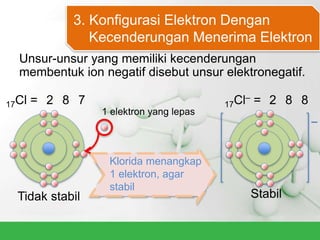
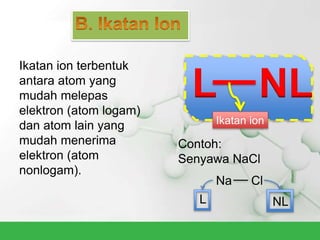
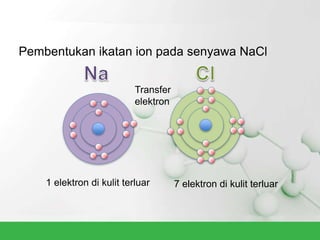
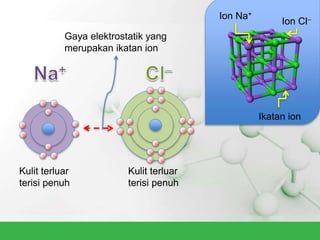
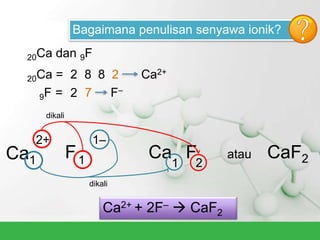
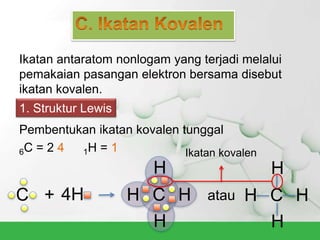
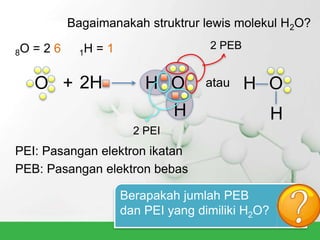
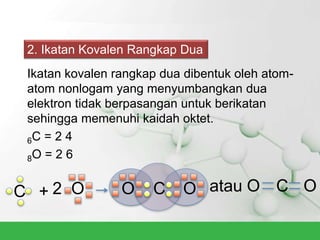
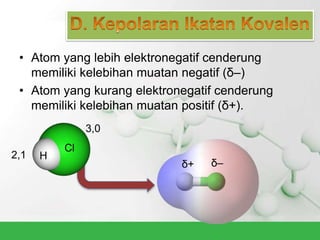
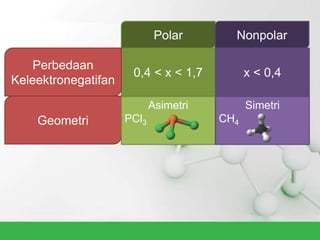
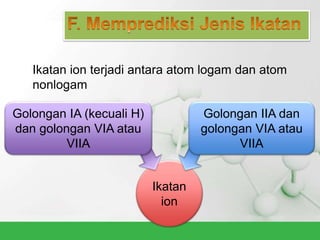
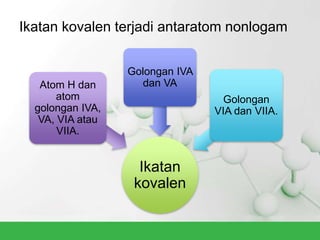
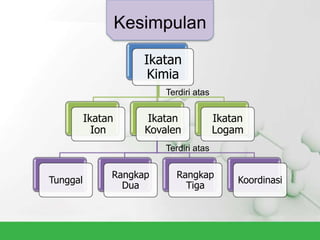
Natrium klorida terbentuk dari ikatan ion antara atom natrium dan klorida. Atom natrium melepaskan elektronnya untuk membentuk ion positif agar stabil, sedangkan atom klorida menerima elektron tersebut untuk membentuk ion negatif. Ikatan ion ini terjadi karena adanya gaya elektrostatik antara ion Na+ dan Cl-.