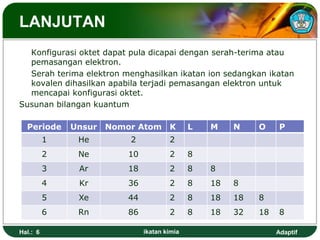
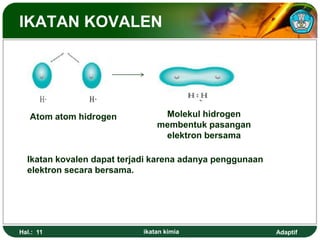
Dokumen ini membahas tentang ikatan kimia, termasuk ikatan ion, kovalen, dan logam, serta konsep elektronegativitas dan konfigurasi elektron yang mendasarinya. Tujuan pembelajaran yang dijelaskan mencakup pemahaman siswa mengenai struktur dan polaritas ikatan, serta penggunaan lambang Lewis dalam menggambarkan elektron. Selain itu, dokumen ini juga mencakup penyimpangan aturan oktet dan sifat-sifat senyawa ion dan kovalen.