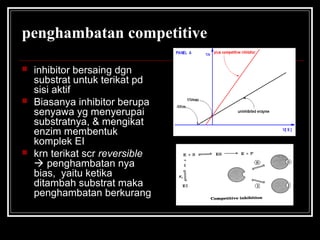
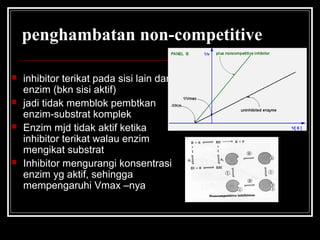
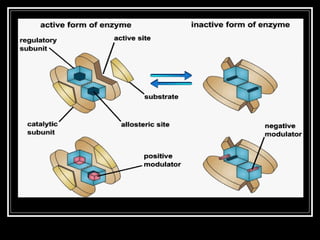
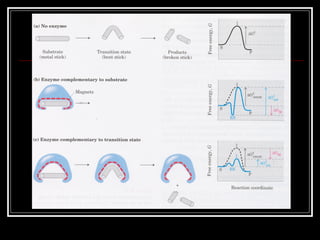
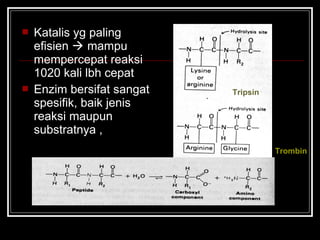
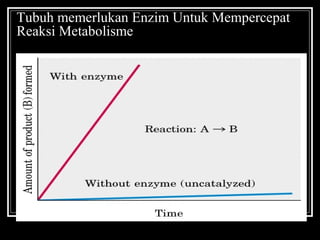
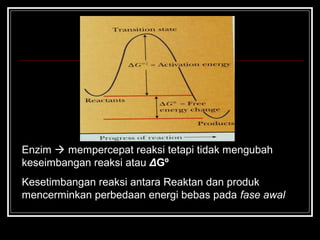
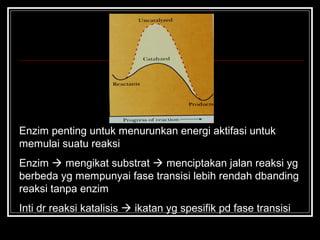
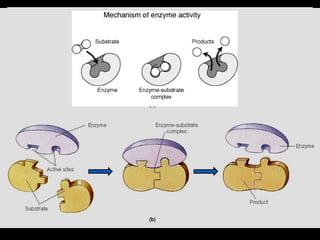
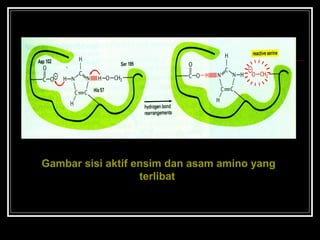
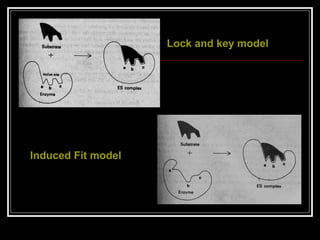
Enzim merupakan protein yang berfungsi sebagai katalisator untuk mempercepat reaksi kimia dalam tubuh dengan menurunkan energi aktivasi. Enzim bekerja dengan cara mengikat substrat di sisi aktifnya dan menciptakan lingkungan yang memungkinkan terjadinya reaksi. Aktivitas enzim dipengaruhi oleh berbagai faktor seperti pH, suhu, konsentrasi substrat, dan inhibitor.

















![Faktor-faktor yg mempengaruhi kerja
enzim
pH setiap enzim mempunyai pH optimum utk
bekerja.
contoh : pepsin pH 2, amylase pH 7.0
Temperatur setiap kenaikan suhu 10˚C
(sampai 40˚C), kecepatan reaksi naik 2 x lipatnya
dan reaksi terhambat dan berhenti pada 60˚C.
Mengapa?
[S] dan atau [E]](https://image.slidesharecdn.com/3-enzim-130502203713-phpapp02/85/3-enzim-27-320.jpg)

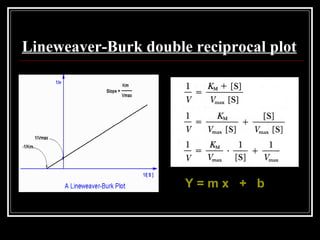
![K-1 + K2
= Km konstanta Michaelis
K2
Vmax [S]
V = Persamaan Michaelis-Menten
Km + [S]](https://image.slidesharecdn.com/3-enzim-130502203713-phpapp02/85/3-enzim-29-320.jpg)
![ Ketika kondisi diatur sehingga [S] = Km maka
Vmax [S]
V = dan V = Vmax / 2
[S] + [S]](https://image.slidesharecdn.com/3-enzim-130502203713-phpapp02/85/3-enzim-30-320.jpg)