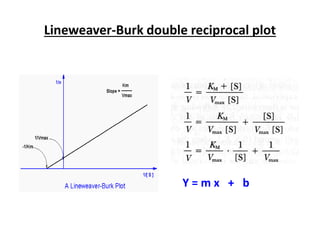
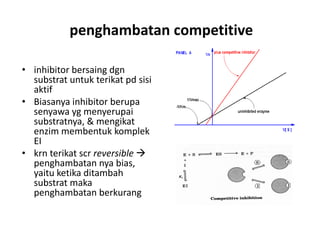
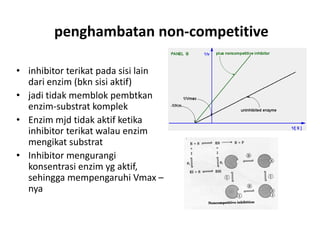
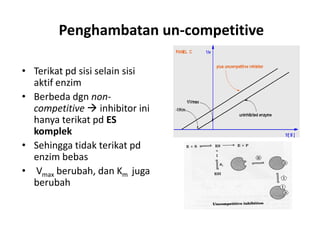
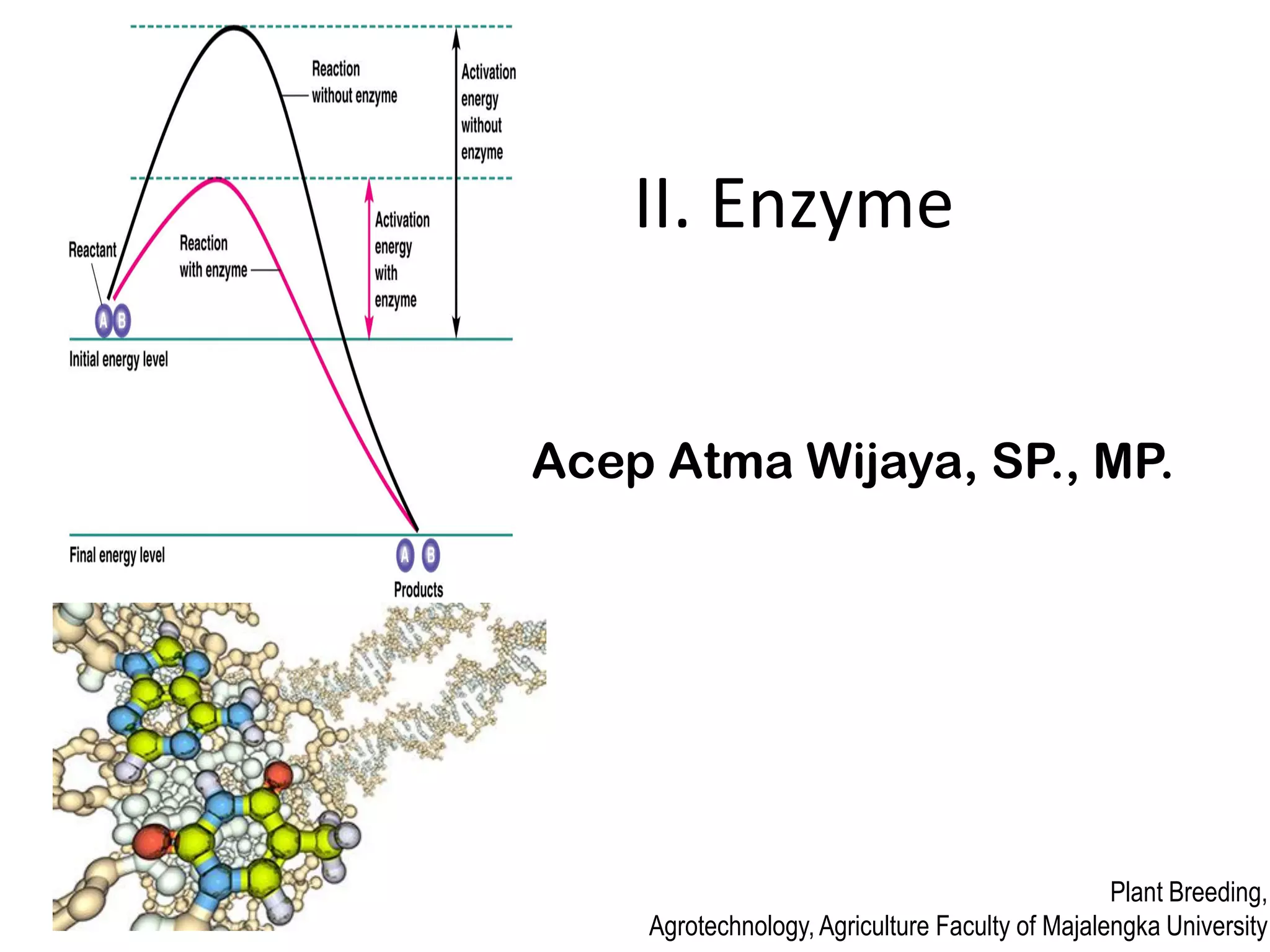
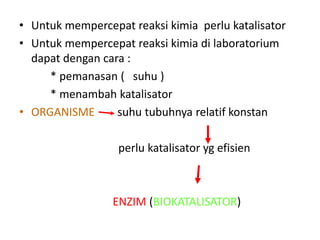
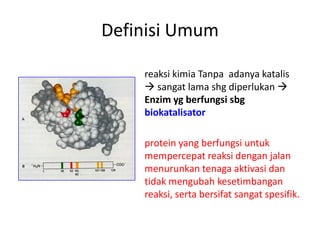
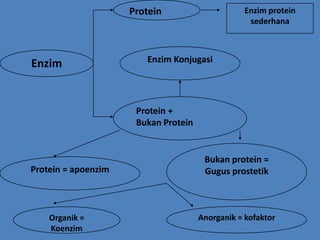
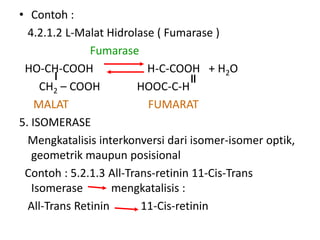
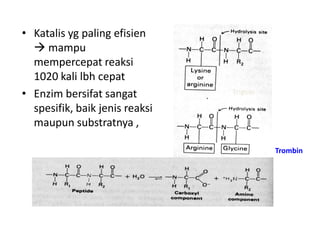
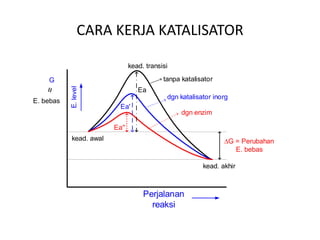
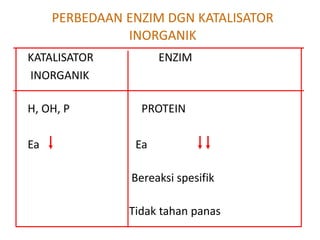
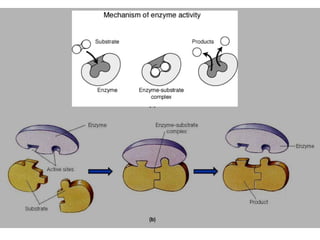
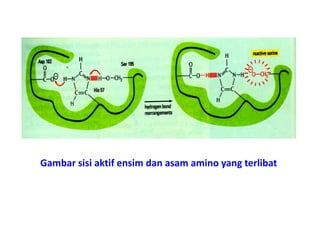
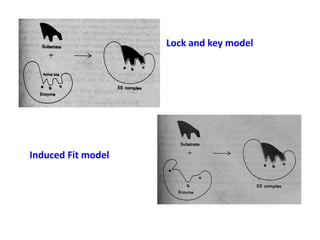
Dokumen ini membahas tentang enzim sebagai biokatalisator yang penting untuk mempercepat reaksi kimia dengan menurunkan energi aktivasi tanpa mengubah kesetimbangan reaksi. Enzim dikelompokkan dalam enam kelas utama dan berfungsi dengan mekanisme tertentu yang melibatkan sisi aktif serta dapat dipengaruhi oleh faktor-faktor seperti pH dan suhu. Selain itu, aktivitas enzim dapat dihambat secara reversible atau irreversible melalui berbagai jenis penghambatan.
















![Faktor-faktor yg mempengaruhi kerja enzim
• pH setiap enzim mempunyai pH optimum utk
bekerja.
contoh : pepsin pH 2, amylase pH 7.0
• Temperatur setiap kenaikan suhu 10˚C (sampai
40˚C), kecepatan reaksi naik 2 x lipatnya dan reaksi
terhambat dan berhenti pada 60˚C. Mengapa?
• [S] dan atau [E]](https://image.slidesharecdn.com/enzyme-230320224559-f7d2285f/85/Enzyme-pdf-28-320.jpg)

![K-1 + K2
= Km konstanta Michaelis
K2
Vmax [S]
V = Persamaan Michaelis-Menten
Km + [S]](https://image.slidesharecdn.com/enzyme-230320224559-f7d2285f/85/Enzyme-pdf-30-320.jpg)
![• Ketika kondisi diatur sehingga [S] = Km maka
Vmax [S]
V = dan V = Vmax / 2
• [S] + [S]](https://image.slidesharecdn.com/enzyme-230320224559-f7d2285f/85/Enzyme-pdf-31-320.jpg)