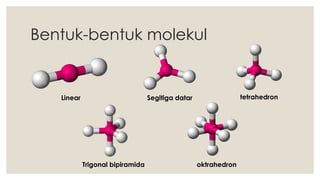
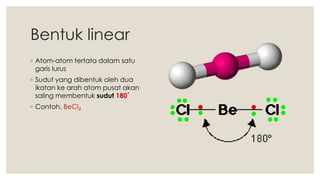
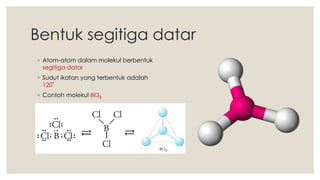
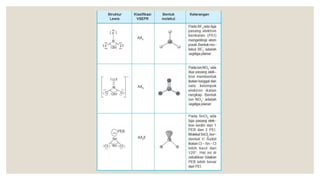
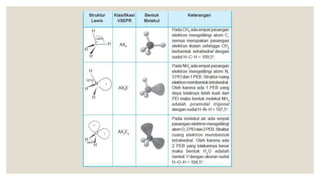
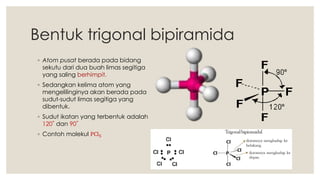
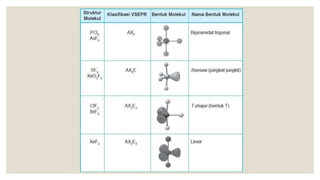
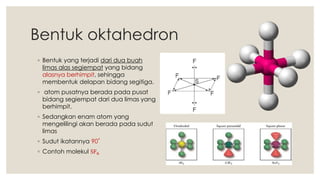
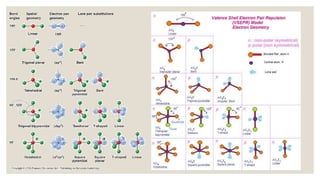
Dokumen ini menjelaskan tentang bentuk molekul dan pendekatan teori tolakan pasangan elektron (VSEPR) yang digunakan untuk menentukan bentuk molekul berdasarkan kedudukan pasangan elektron. Berbagai bentuk molekul seperti linear, segitiga datar, tetrahedron, trigonal bipiramida, dan oktahedron dijelaskan beserta contoh dan sudut ikatan masing-masing. Proses meramal bentuk molekul juga diungkapkan dengan langkah-langkah yang konkret.