Ringkasan dokumen tersebut adalah:
Titrasi redoks adalah titrasi antara analit dan titran yang melibatkan reaksi redoks. Terdapat beberapa jenis titrasi redoks seperti permanganometri, dikromatometri, dan cerimetri. Titrasi redoks memerlukan syarat tertentu seperti hanya satu reaksi yang terjadi pada titik ekivalensi dan adanya indikator. Contoh soal titrasi redoks larutan besi(II) dengan serium(






![Awal titrasi
Ce4+ + e Ce3+
Fe2+ Fe3+ + e
Fe2+ + Ce4+ Fe3+ + Ce3+
Angka Banding, Fe2+ : Fe3+ = 1000:1
E = E0 - 0,059 log [Fe2+]
n [Fe3+]
= 0,68 - 0,059 log 1000
1
= 0,50 Volt
Dengan asumsi oksidasi 0,1%](https://image.slidesharecdn.com/titrasiredoks-130525172255-phpapp01/85/Titrasi-redoks-7-320.jpg)
![Ditambahkan 10 mL Ce4+
Fe2+ + Ce4+ Fe3+ + Ce3+
M 5 1 - -
R 1 1 1 1
S 4 - 1 1
E = 0,68 - 0,059 log [Fe2+]
n [Fe3+]
= 0,68 - 0,059 log [4/60]
1 [1/60]
= 0,64 Volt
n Fe2+ = V x M
= 50mL x 0.1M
= 5mmol
n Ce4+ = V x M
= 10mL x 0.1M
= 1mmol](https://image.slidesharecdn.com/titrasiredoks-130525172255-phpapp01/85/Titrasi-redoks-8-320.jpg)
![Ditambahkan 20 mL Ce4+
Fe2+ + Ce4+ Fe3+ + Ce3+
M 5 2 - -
R 2 2 2 2
S 3 - 2 2
E = 0,68 - 0,059 log [Fe2+]
n [Fe3+]
= 0,68 - 0,059 log [3/70]
1 [2/70]
= 0,67 Volt
n Fe2+ = V x M
= 50mL x 0.1M
= 5mmol
n Ce4+ = V x M
= 20mL x 0.1M
= 2mmol](https://image.slidesharecdn.com/titrasiredoks-130525172255-phpapp01/85/Titrasi-redoks-9-320.jpg)
![Ditambahkan 45 mL Ce4+
Fe2+ + Ce4+ Fe3+ + Ce3+
M 5 4.5 - -
R 4.5 4.5 4.5 4.5
S 0.5 - 4.5 4.5
E = 0,68 - 0,059 log [Fe2+]
n [Fe3+]
= 0,68 - 0,059 log [0.5/95]
1 [4.5/95]
= 0.74 Volt
n Fe2+ = V x M
= 50mL x 0.1M
= 5mmol
n Ce4+ = V x M
= 45mL x 0.1M
= 4.5mmol](https://image.slidesharecdn.com/titrasiredoks-130525172255-phpapp01/85/Titrasi-redoks-10-320.jpg)
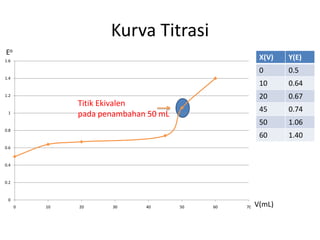
![Ditambahkan 50 mL Ce4+
Fe2+ + Ce4+ Fe3+ + Ce3+
M 5 5 - -
R 5 5 5 5
S - - 5 5
[Fe3+] = [Ce3+] dan [Fe2+] = [Ce4+]
E = 0,68 - 0,059 log [Fe2+]
[Fe3+]
E = 1,44 - 0,059 log [Ce3+]
[Ce4+]
n Fe2+ = V x M
= 50mL x 0.1M
= 5mmol
n Ce4+ = V x M
= 50mL x 0.1M
= 5mmol
Jika digabungkan :
2 E = 2,12 - 0,059 log [Fe2+] [Ce3+]
[Fe3+] [Ce4+]
2 E = 2,12 - 0,059 x log 1
2 E = 2,12 - 0
E = 1,06 Volt](https://image.slidesharecdn.com/titrasiredoks-130525172255-phpapp01/85/Titrasi-redoks-11-320.jpg)
![Ditambahkan 60 mL Ce4+
Fe2+ + Ce4+ Fe3+ + Ce3+
M 5 6 - -
R 5 5 5 5
S - 1 5 5
E = 1.44 - 0,059 log [Ce3+]
n [Ce4+]
= 1.44 - 0,059 log [5/160]
1 [1/160]
= 1.40 Volt
n Fe2+ = V x M
= 50mL x 0.1M
= 5mmol
n Ce4+ = V x M
= 60mL x 0.1M
= 6mmol](https://image.slidesharecdn.com/titrasiredoks-130525172255-phpapp01/85/Titrasi-redoks-12-320.jpg)