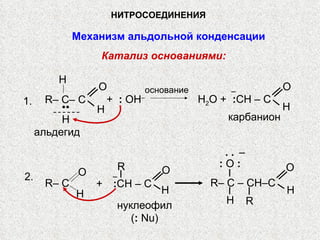
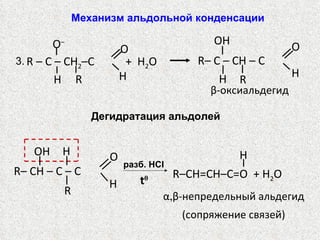
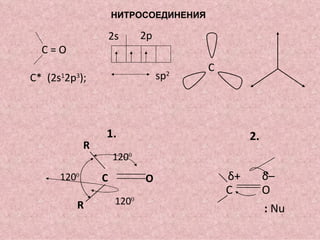
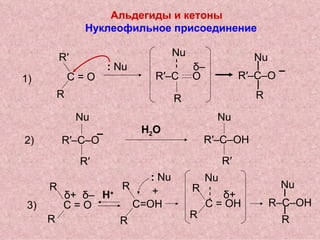
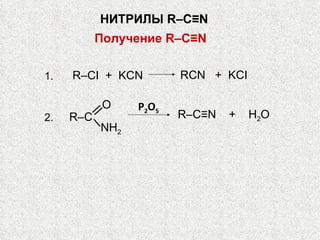
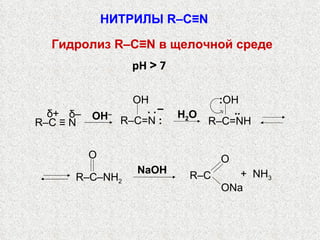
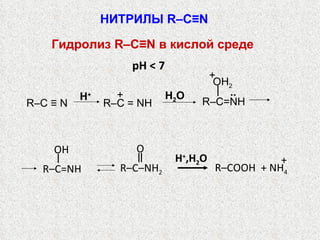
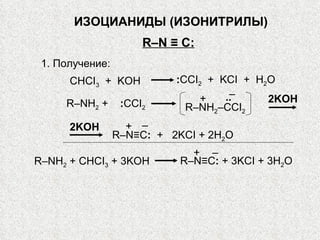
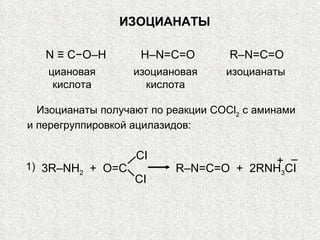
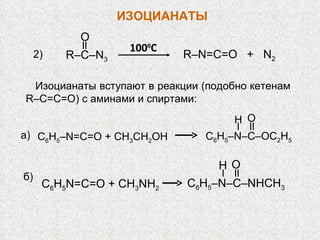
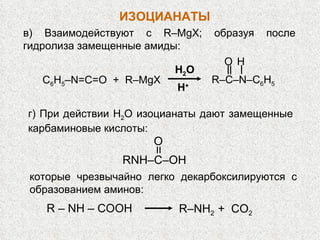
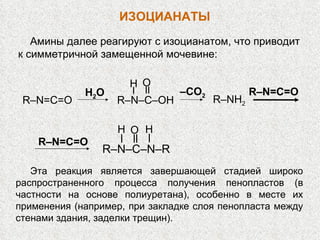
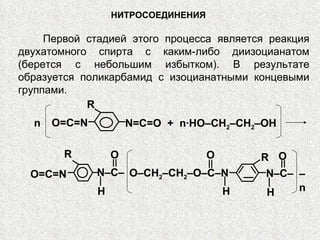
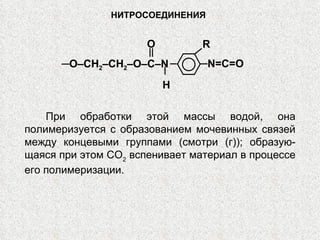
Документ охватывает свойства, структуру и химические реакции нитросоединений. Описываются способы получения, термодинамическая неустойчивость и применение нитросоединений в качестве взрывчатых веществ. Также рассматриваются их реакции с карбонильными соединениями и механизмы альдольной конденсации.
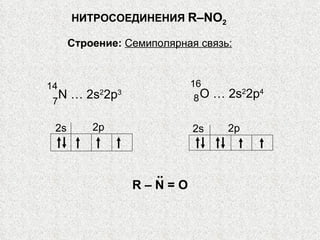
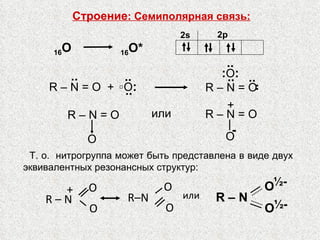

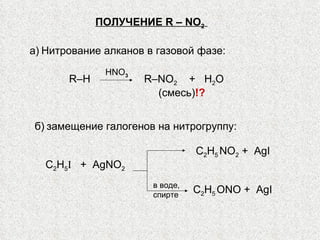
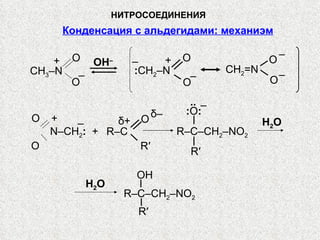
![ХИМИЧЕСКИЕ СВОЙСТВА НИТРОСОЕДИНЕНИЙ 1. Восстановление до аминов (для Ar – NH 2 ). 2. Очень важны реакции по α – H: а) Кислотные свойства. Псевдокислоты. Первичные и вторичные нитросоединения, несмотря на то, что они кажутся нейтральными (например, по отношению к обычным индикаторам), образуют соли с едкими щелочами CH 3 N О 2 + Na + ОН - -> [ CH 2 = N О 2 ] – Na + + Н 2 О Эта реакция отличается от нейтрализации обычной кислоты, протекающей мгновенно, тем, что она протекает очень медленно (имеет измеримую скорость реакции). Подобные кислоты называются псевдокислотами.](https://image.slidesharecdn.com/24-120111010721-phpapp01/85/slide-5-320.jpg)
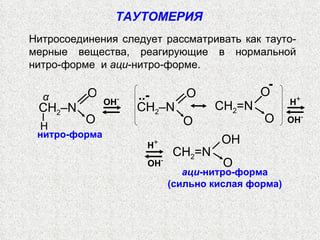


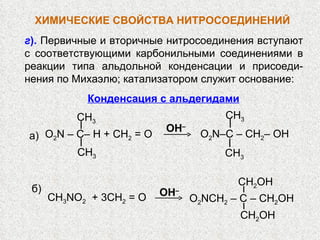
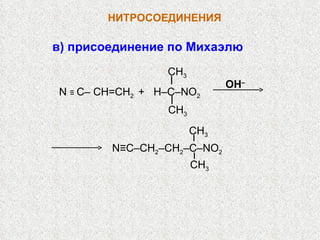
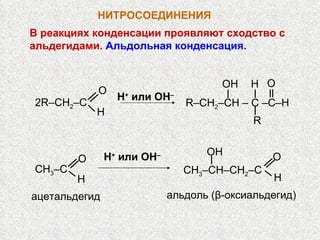
![НИТРОСОЕДИНЕНИЯ Конденсация с альдегидами : CH 3 NO 2 + CH 2 O O 2 N–CH 2 –CH 2 OH CH 2 O нитро-метан формаль- дегид O 2 N–CH(CH 2 OH) 2 O 2 N–C(CH 2 OH) 3 CH 2 O CH 2 O [H] H 2 N–C(CH 2 OH) 3 О 2 N–C(CH 2 O N O 2 ) 3 HO–NO 2 O Н ‒ Аминоспирт используется в произ- водстве моющих средств, эмульгаторов Эфиры нитроспиртов ценные взрывчатые вещества](https://image.slidesharecdn.com/24-120111010721-phpapp01/85/slide-11-320.jpg)