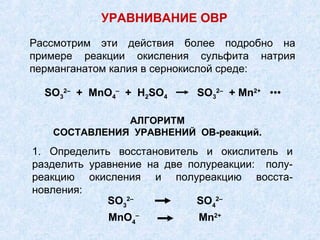
Документ описывает окислительно-восстановительные реакции, включая их классификацию и уравнивание. Рассматриваются межмолекулярные и внутримолекулярные реакции, диспропорционирование и конпропорционирование, а также алгоритм составления уравнений. Также приводится информация о электролизе и законе Фарадея, включая расчеты, связанные с протеканием электричества через электролиты.









![ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ. УРАВНЕНИЕ НЕРНСТА
Количественной мерой способности окисленной
формы окислительно–восстановительной пары при-
соединять электроны и стремление восстанов-
ленной формы отдавать их служит электродный
потенциал (ЭП).
ЭП зависит от природы ОВ – пары, концентрации
окисленной [Ox] и восстановленной [Red] форм
вещества, температуры и описывается уравне-
нием Нернста:
Н+
(p) + ē 1/2 Н2 (г)
ZF
φ = φº +
[Ox]RT
[Red]
ln
где φº – стандартный электродный потенциал
Значения φº берутся относительно системы:
φºН+/½ Н2 = 0](https://image.slidesharecdn.com/16-130526065547-phpapp02/85/16-11-320.jpg)
![CuZn
Cu2+
Zn2+
CuSO4ZnSO4
Me + nH2O [Me(H2O)n] Z+
+ Z ē
Me Me Z+
+ Z ē
или](https://image.slidesharecdn.com/16-130526065547-phpapp02/85/16-12-320.jpg)
![Zn Zn 2+
+ 2 ē / φº 298 = – 0,76 B/
Cu Cu 2+
+ 2 ē / φº 298 = + 0,34 B/
RT [Ox]
φ = φº + ln R = 8,31 Дж/(моль∙К)
ZF [Red] Т = tº + 273
F = 96500 Кл
0,059
φ = φº + ln [MeZ+
]
Z
Z – число электронов](https://image.slidesharecdn.com/16-130526065547-phpapp02/85/16-13-320.jpg)

![Равновесие:
H+
+ 2 ē = Н2
φºН+ / ½ Н2 =
0
[H+
] = 1 моль/л
а[H+] = 1
Р = 101,3 кПа](https://image.slidesharecdn.com/16-130526065547-phpapp02/85/16-15-320.jpg)











