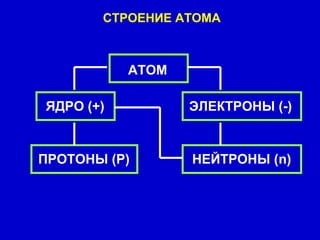
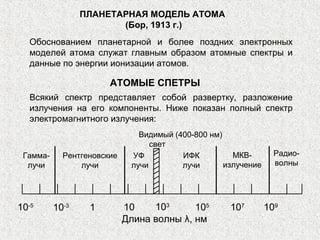
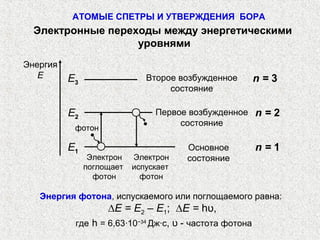
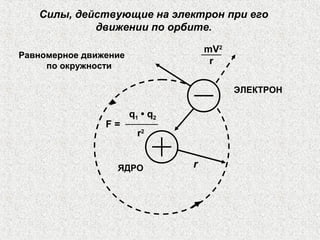
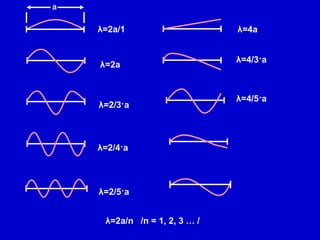
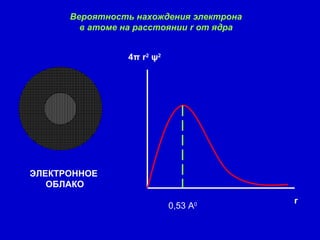
Документ описывает модели строения атома, включая модель 'сливового пудинга' Томсона, ядерную модель Резерфорда и планетарную модель Бора. В нем также представлены концепции атомного спектра, квантования энергии, корпускулярно-волновой двойственности и принципа неопределенности. Основное внимание уделяется уравнению Шредингера и волновым функциям, описывающим движение электронов в атоме.