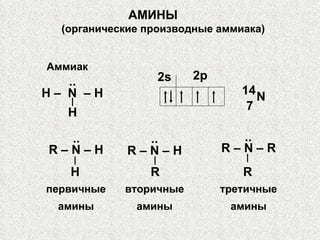
Амины
- 1. АМИНЫ (органические производные аммиака) Аммиак H – N – H H .. N 14 7 R – N – H первичные амины .. H R – N – H вторичные амины .. R R – N – R третичные амины .. R 2s 2p
- 2. АМИНЫ Образование иона аммония: [ NH 4 ] + NH 3 + H + [ NH 4 ] + Четвертичный аммониевый ион: [ NH 4 ] + OH – [ NH 4 ] + CI – [ NR 4 ] + CI – [ NR 4 ] + OH – ЧАО R – N – R R R + гидроксид аммония ЧАС
- 4. АМИНЫ a) CH 3 CH 2 CI CH 3 CH 2 NH 2 (CH 3 CH 2 ) 2 NH NH 3 – HCI CH 3 CH 2 CI (CH 3 CH 3 ) 2 N CH 3 CH 2 CI б ) CH 3 COOH CICH 2 COOH CI 2 ,P 2NH 3 - HCI CH 2 –COONH 4 + – NH 2 H 2 N CH 2 COOH H +
- 5. АМИНЫ Замещение галогена на NH 3 проводят, выдерживая смесь реагентов при комнатной температуре, либо нагревают под давлением. Вначале замещение дает соль амина, из которой свободный амин выделяют обработанной щелочью: R–X + NH 3 RNH 3 X + – RNH 3 X RNH 2 + NaX + H 2 O + – NaOH
- 6. АМИНЫ Механизм реакции аминирования: это S N – реакция; : Nu = NH 3 или RNH 2 .. H 3 N : + R–X δ+ [H 3 N … R … X] δ+ δ– [H 3 NR] X + Недостатки реакции: Выход первичных RNH 2 занижен из-за образования высших аминов R 2 NH , R 3 N Н. Избыток NH 3 уменьшает степень образования R 2 NH , R 3 N , R 4 N + X – . – ..
- 7. АМИНЫ. Получение 2. Получение аминов из спиртов: RCH 2 OH RCH 2 X RCH 2 NH 2 RCH 2 NH 2 AI 2 O 3 ,NH 3 400 0 C NH 3 HX,PX 3 CH 3 OH + NH 3 CH 3 NH 2 + H 2 O AI 2 O 3 ,400 0 C
- 8. АМИНЫ. Получение 3. Каталитическое восстановление альдегидов или кетонов в присутствии NH 3 или RNH 2 . R – C O R R 2 CH– NH 2 NH 3 ,H 2 ,Ni альдегид или кетон первичный или вторичный радикал R–C≡N R–CH 2 –NH 2 H 2 ,Ni нитрил
- 9. 4. Восстановление нитрилов: Примеры: CH 3 CH 2 –CI CH 3 CH 2 –C≡N CH 3 –CH 2 –CH 2 – NH 2 Na + CN – H 2 /Ni Ar–NO 2 + 6H R–NH 2 + 2H 2 O C 6 H 5 NO 2 + 3(NH 4 ) 2 S C 6 H 5 NH 2 + 6NH 3 + 3S + 2H 2 O +3 – 2 – 3 0 а) C 6 H 5 NO 2 + 9Fe + 4H 2 O 4C 6 H 5 NH 2 + 3Fe 3 O 4 +3 – 3 3Fe 2 O 3 ∙FeO б) АМИНЫ. Получение
- 10. Реакция а) – реакция Зинина Расщепление амидов по Гоффману. + Br 2 + 4NaOH R – C R–NH 2 + 2NaBr + Na 2 CO 3 + 2H 2 O АМИНЫ. Получение N 3+ + 6e – + N 3– 3Fe – 6e – = 3Fe 2+ 6Fe – 18e – = 6Fe 3+ 4 1 O NH 2
- 11. Представляет интерес сравнить три реакции: RCH 2 OH RCH 2 Br R–COOH R – C NH 2 R – C CI R–NH 2 Cu R–CH 2 –NH 2 R–CH 2 NH 2 RCH 2 C≡N R–CH 2 –CH 2 –NH 2 R – C O H Ni NH 3 , H 2 увеличение цепи на 1С без изменения длины N а CN NH 3 KMnO 4 SOCI 2 NH 3 NaOH уменьшение длины PBr 3 АМИНЫ. Получение O O без изменения длины цепи цепи на 1С цепи Br 2 ,
- 12. 5. Гидролиз нитрилов R – C ≡ N H 2 O R–C=N : .. – R–C = N– Н : OH OH R–C ≡ N нитрил [OH – ] H 2 O R–C OH NH 2 H 2 O,OH – + NH 3 ↑ R–C OH O – амид соль кислоты АМИНЫ. Получение
- 13. АМИНЫ ХИМИЧЕСКИЕ СВОЙСТВА АМИНОВ 1. Основность: .. NH 3 + H 2 O NH 4 + + OH – .. RNH 2 + H 2 O RNH 3 + + OH – K в = [RNH 3 + ]∙ [OH – ] [R–NH 2 ] ≈ 10 -5 ÷ 10 -4
- 14. АМИНЫ . ХИМИЧЕСКИЕ СВОЙСТВА Влияние радикала на основность: H 2 N .. H 2 N δ– δ– δ– δ+ или К в = 3800∙10 -13 H 2 N .. NO 2 К в = 1,3∙10 -13 электроноакцепторный заместитель
- 15. Характер изменения основности: NH 3 .. < < < R–NH 2 .. .. R–NH–R R–NH–R .. Радикал R – является электродонорным Два фактора: 1. Делокализация «+» за счет R 2.Сольватация (число «Н» – связей) B : + H + BH + АМИНЫ . ХИМИЧЕСКИЕ СВОЙСТВА R
- 16. 2. Алкилирование: Действием влажной окиси серебра Ag 2 O на ЧАС получают четвертичные аммониевые основания R 4 N + OH – ( ЧАО ): R 4 N + OH – + AgX↓ R 4 N + X – Ag 2 O H 2 O АМИНЫ. ХИМИЧЕСКИЕ СВОЙСТВА Конечным продуктом алкилирования являются четвертичные алкиламмониевые соли R 4 N + Х – ( ЧАС ) NH 3 RNH 2 R 2 NH R 3 N R 4 N + X – RX RX RX RX
- 17. АМИНЫ. ЧАО В ПРИРОДЕ Некоторые ЧАО физиологически активны: холин Регулирует рост, обмен жиров, белков, входит в состав лецитинов CH 2 –N–CH 2 –CH 2 –OH + OH – С H 2 OCOR С H –OCOR С H 2 –O–R– С OCH 2 CH 2 –N–CH 3 O O – + Лецитины- составная часть биолог. мембран [( CH 3 ) 3 N + CH 2 CH 2 OC ОС H 3 ]ОН – Ацетилхолин – медиатор, участвует в передаче нервного возбуждения CH 3 CH 3 CH 3 CH 3
- 18. АМИНЫ. АЛКИЛИРОВАНИЕ Общая схема: R 3 N : + R′– I [R 3 NR′] I + – δ– δ+ Примеры: (CH 3 ) 3 N : + CH 3 I [(CH 3 ) 4 N] I + – δ– δ+ C 6 H 5 NH 2 + C 2 H 5 CI + CI – .. - + [С 6 H 5 – NH 2 –С 2 H 5 ] Cl + KOH .. С 6 H 5 – NH –С 2 H 5 + KCl + H 2 O соль амин NH 2 C 2 H 5 C 6 H 5
- 19. АМИНЫ Задача. При нагревании С H 3 CH 2 CH – N ( CH 3 ) 3 ОН – вступает в реакцию отщепления. Предскажите продукты и предложите механизм этой реакции. +
- 20. 3. Ацилирование аминов: Первичные и вторичные амины ( но не третичные ) реагируют с производными карбоновых кислот, давая амиды: R – C O NH 2 АМИНЫ. ХИМИЧЕСКИЕ СВОЙСТВА R – C O X R′–NH 2 + .. R – C O NH–R′ + HX ацильное производное
- 21. .. CH 3 – C + CH 3 – СH 2 – NH 2 O CI + HCI CH 3 – C O NHCH 2 CH 3 1) + CH 3 OH R – C O NHCH 2 CH 3 .. CH 3 – C + CH 3 СH 2 NH 2 O OCH 3 2) 3. АЦИЛИРОВАНИЕ АМИНОВ:
- 22. МЕХАНИЗМ ПРОЦЕССА (A) C 2 H 5 –N : + C–CH 3 H H δ– δ+ C 2 H 5 –N – C–CH 3 – + хлорангидрид укс.кислоты C 2 H 5 –N – C–CH 3 CI H OH (B) N- этилэтанамид – HCI C 2 H 5 –N – C–CH 3 3. АЦИЛИРОВАНИЕ АМИНОВ: амин O CI CI H H O H O
- 23. ПРОБА ГИНСБЕРГА Первичные, вторичные и третичные амины, можно различить в их реакции с бензолсульфонил-хлоридом: R–NH 2 + C 6 H 5 –S–CI O O C 6 H 5 –SO 2 –NHR сульфонамид растворим в NaOH R 2 NH + C 6 H 5 –S–CI O O C 6 H 5 SO 2 NR 2 сульфонамид нерастворим в NaOH R 3 N + C 6 H 5 SO 2 CI не идет АЦИЛИРОВАНИЕ АМИНОВ:
- 24. (А) (В) R–N : + O=C–R′ H H H + H R– N – C –R′ – O H H .. R– N – C –R′ H H OH R – N = CH – R′ (основания Шиффа или имины) .. – H 2 O 4. Взаимодействие с альдегидами и кетонами: АМИНЫ. ХИМИЧЕСКИЕ СВОЙСТВА
- 25. 4. Взаимодействие с альдегидами и кетонами: C = O + H 2 N С 2 Н 5 CH 3 CH 3 C = N С 2 H 5 + H 2 O CH 3 CH 3 CH 3 –C – N–C 2 H 5 + O - CH 3 –C=O + : N–C 2 H 5 H H – H 2 O OH CH 3 –CH–NH–C 2 H 5 CH 3 –CH=N–C 2 H 5 АМИНЫ. ХИМИЧЕСКИЕ СВОЙСТВА H H H механизм
- 26. 5. Взаимодействие аминов с азотистой кислотой H 2 O + N + = O + Cl – HO – N = O + HCl 5.1. Ароматические амины дают соли диазония: Ar – NH 2 + NaNO 2 + HCl .. [Ar–N≡N] + Cl – + NaCl + H 2 O 5.2. Первичные алифатические амины дезаминиру-ются с выделением азота: R–OH + N 2 + H 2 O R–NH 2 + HNO 2 АМИНЫ. ХИМИЧЕСКИЕ СВОЙСТВА
- 27. R 2 HN : + N = O [R 2 HN + – N ≡ N] 5. 3 . N – нитрозоамин R 2 N – N = O – H + 5.4. Третичные амины алифатического ряда на холоду не реагируют, а ароматические дают n –нитрозо-соединения: ( CH 3 ) 2 – N– – + N = O – H + (CH 3 ) 2 N– – NO 5. АМИНЫ. ВЗАИМОДЕЙСТВИЕ С АЗОТИСТОЙ КИСЛОТОЙ + +
- 28. АМИНЫ МЕХАНИЗМ РЕАКЦИИ С HNO 2 R – N – N = O + – N : + N = O + и далее в случае первичных аминов: H R – N – N = O + – H + R – N = N‒OH H + R – N ≡ N + H 2 O + R – N ≡ N + R – CH 2 + N 2 + H R
- 29. АМИНЫ H 2 O R – CH 2 – OH R – CH 2 + – H + – H + R – CH 2 = CH 2 АМИНЫ МЕХАНИЗМ РЕАКЦИИ С HNO 2
- 30. Важнейшие представители аминов H 2 N – ( CH 2 ) 6 – NH 2 1. Гексаметилендиамин 2. Анилин NH 2 NO 2 H 2 SO 4 [Н] 3. сульфаниловая к-та конц. H 2 N SO 3 H
- 31. 4. сульфаниламид (стрепоцид) H 2 N SO 2 –NH 2 5. носульфазол – NH–SO 2 NH 2 N S 6 . эта зол – NH–SO 2 NH 2 N S N С 2 Н 5 – 7 . фталазол NH– С O HOOC – NH–SO 2 S N Важнейшие представители аминов
