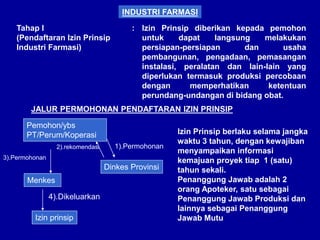
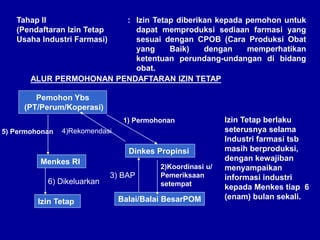
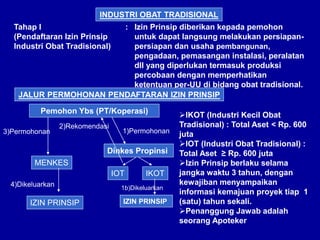
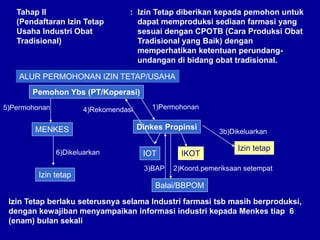
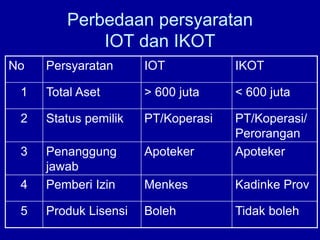
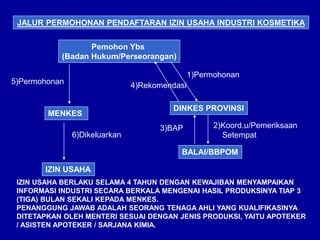
Dokumen tersebut membahas tentang persyaratan pendaftaran dan registrasi produk farmasi seperti obat jadi, obat tradisional, dan kosmetika. Termasuk di dalamnya adalah peraturan yang mengatur bidang tersebut, proses permohonan izin usaha, persyaratan sarana produksi, dan sanksi yang diberikan apabila tidak memenuhi persyaratan.