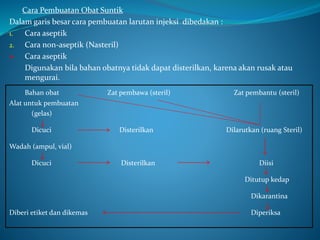
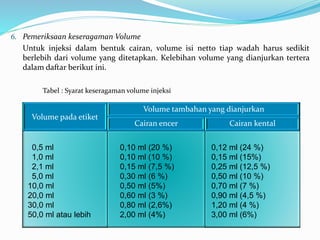
Dokumen ini membahas tentang bahan pembantu dalam pembuatan injeksi, termasuk tujuan penggunaan seperti mendapatkan pH optimal, larutan isotonis, dan stabilisasi. Terdapat juga penjelasan mengenai pemeriksaan yang harus dilakukan setelah pembuatan larutan injeksi, termasuk pemeriksaan kebocoran, sterilitas, dan pirogenitas. Selain itu, dijelaskan syarat wadah dan tutup karet yang baik untuk injeksi serta cara sterilisasi yang diperlukan.