More Related Content
PDF
สารอินทรีย์ และหมู่ฟังก์ชัน : Organic Compounds and Functional Groups PDF
PDF
PDF
มวลอะตอม มวลโมเลกุล มวลไอออน PDF
PDF
ชุดกิจกรรมการเรียนรู้ชุดที่1พันธะโคเวเลนต์docx PPTX
PDF
What's hot
PDF
PDF
ใบความรู้ เรื่อง การทำนายรูปร่างโมเลกุลโคเวเลนต์ PDF
ใบความรู้ที่ 1 สภาพขั้วของโมเลกุลโคเวเลนต์ PDF
PDF
PDF
อัตราการเกิดปฏิกิริยาเคมี PDF
เอกสารประกอบการเรียน เคมีอินทรีย์ 2 PDF
แนวคิดเกี่ยวกับการเกิดปฏิกิริยาเคมี เล่ม3 PDF
แผนการจัดการเรียนรู้ที่ 9 อนุภาคในอะตอม.pdf PDF
ฟิสิกส์ 5 ไฟฟ้าสถิตย์ ตอนที่ 4 PDF
PDF
PDF
วิทยาศาสตร์กายภาพ 1 เรื่อง อากาศ PDF
PDF
PPT
ปัจจัยที่มีผลต่อภาวะสมดุล PDF
แบบทดสอบความหลากหลายทางชีวภาพ PDF
PDF
PPTX
Similar to เคมีอินทรีย์ Organic-chemistry
PPT
PDF
PDF
PPT
DOC
PPTX
PDF
PDF
PDF
PPT
PDF
พันธะโคเวเลนต์ Covalent Bond PDF
ปริมาณสารสัมพันธ์ - Stoichiometry PDF
PDF
PPT
256121 ch2 hc 1-alkane & cycloalkane PPT
PDF
Unit 2 สารเคมีในเซลล์ของสิ่งมีชีวิต สารชีวโมเลกุล PPT
PDF
PDF
More from porpia
PDF
โครงร่างโครงงาน Organic-chemistry PPT
DOC
DOC
DOC
PDF
PDF
PDF
PDF
PDF
PDF
เคมีอินทรีย์ Organic-chemistry
- 1.
- 2.
ประวัติและความสาคัญของวิชาเคมีอินทรีย์
(Organic Chemistry Background)
เคมีอินทรีย์(Organicchemistry)เป็นสาขาหนึ่งของวิชาเคมีว่าด้วยการศึกษาโครงสร้าง คุณสมบัติ
องค์ประกอบของธาตุคาร์บอน ซึ่งพบในธรรมชาติ และเป็นองค์ประกอบของสิ่งมีชีวิต
ในปี ค.ศ. 1828 เฟรดริช วูห์เลอร์ (Friedrich Woehler) สามารถสังเคราะห์สารประกอบยูเรียได้เป็นผลสาเร็จ
โดยบังเอิญจากการระเหย สารละลายแอมโมเนียมไซยาเนต(ammoniumcyanate) NH4OCN
เฟรดริช วูห์เลอร์ (Friedrich Woehler)
- 3.
- 4.
พันธะเคมี (Chemical Bonding)
ทฤษฏีพันธะ(Chemical Bonding Theory) เป็นการศึกษาสมบัติทาง
กายภาพ และสมบัติทางเคมีของสารอินทรีซึ่งส่วนใหญ่จะประกอบด้วยพันธะ C
ที่เกิดจากการใช้คู่อิเล็กตรอนร่วมกันเรียกว่า พันธะโคเวเลนต์(Covalent bond)
โดย C จะมีการจัดเรียงตัวของ e- ดังนี้ 1s2 2s2 2p2 ซึ่งจากการตัดเรียนตัว
ดังกล่าวจะพบว่า C มีอิเล็กตรอนเดี่ยว 2 ตัวก็น่าจะสร้างได้เพียง 2 พันธะ แต่ใน
ความเป็นจริง C กลับสร้างได้ถึง 4 พันธะ ทฤษฏีที่ใช้อธิบายหลังการดังกล่าว
เรียกว่า ทฤษฏีพันธะเวเลนต์(Valent Bond Theory)
ทฤษฏีพันธะเวเลนต์ (Valent Bond Theory) เป็นทฤษฎีที่ใช้ในการ
อธิบายการเกิดพันธะที่ซ้อนเหลื่อมกัน กล่าวคือ C ได้รับพลังงานในถ่ายเถ e- 1ตัว
จากออร์บิทอล 2s ไปสู่ 2p (1s2 2s1 2px
1 2py
1 2pz
1 ) เกิดการผสมกันของ e- ใน
ออร์บิทอล 2s และ 2p จะเรียกการผสมแบบนี้ว่า ไฮบริไดเซชัน
- 5.
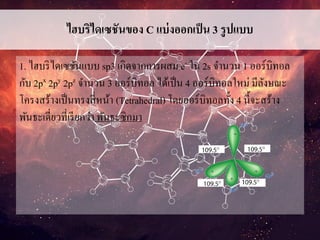
ไฮบริไดเซชันของ C แบ่งออกเป็น3 รูปแบบ
1. ไฮบริไดเซชันแบบ sp3 เกิดจากการผสม e- ใน 2s จานวน 1 ออร์บิทอล
กับ 2px 2py 2pz จานวน 3 ออร์บิทอล ได้เป็น 4 ออร์บิทอลใหม่ มีลังษณะ
โครงสร้างเป็นทรงสี่หน้า (Tetrahedral) โดยออร์บิทอลทั้ง 4 นี้จะสร้าง
พันธะเดี่ยวที่เรียกว่า พันธะซิกมา
- 6.
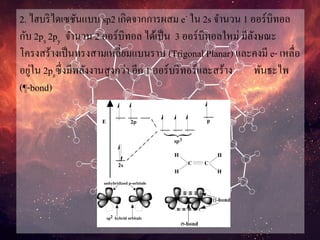
2. ไฮบริไดเซชันแบบ sp2เกิดจากการผสม e- ใน 2s จานวน 1 ออร์บิทอล
กับ 2px 2py จานวน 2 ออร์บิทอล ได้เป็น 3 ออร์บิทอลใหม่ มีลังษณะ
โครงสร้างเป็นทรงสามเหลี่ยมแบนราบ (Trigonal Planar) และคงมี e- เหลื่อ
อยู่ใน 2pzซึ่งมีพลังงานสูงกว่า อีก 1 ออร์บริทอร์และสร้าง พันธะไพ
(¶-bond)
- 7.
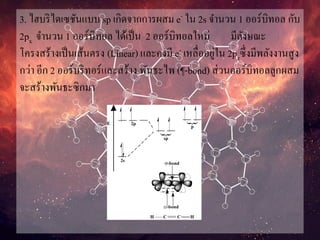
3. ไฮบริไดเซชันแบบ spเกิดจากการผสม e- ใน 2s จานวน 1 ออร์บิทอล กับ
2px จานวน 1 ออร์บิทอล ได้เป็น 2 ออร์บิทอลใหม่ มีลังษณะ
โครงสร้างเป็นเส้นตรง (Linear) และคงมี e- เหลื่ออยู่ใน 2pzซึ่งมีพลังงานสูง
กว่า อีก 2 ออร์บริทอร์และสร้าง พันธะไพ (¶-bond) ส่วนออร์บิทอลลูกผสม
จะสร้างพันธะซิกมา
- 8.
แรงยึดเหนี่ยวระหว่างโมเลกุลโคเวเลนต์
(Intermolecular Forces)
แบ่งออกเป็น 3ประเภท
1. แรงลอนดอน ( london foece ) เป็นแรงยึดเหนี่ยวระหว่างโมเลกุล ยึด
เหนี่ยวกันด้วยแรงอ่อนๆ ซึ่งเกิดขึ้นในสารทั่วไป และจะมีค่าเพิ่มขึ้นตาม
มวลโมเลกุล
2. แรงดึงดูดระหว่างขั้ว ( dipole – dipole force ) เป็นแรงยึดเหนี่ยนทาง
ไฟฟ้าระหว่งสารประกอบโคเวเลนต์ที่มีขั้ว
3. พันธะไฮโดรเจน (hydrogen bond , H – bond ) เป็นแรงยึดเหนี่ยว
ระหว่างโมเลกุลที่มี H เป็นองค์ประกอบ
- 9.
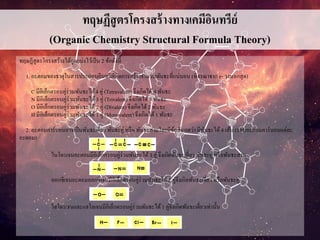
ทฤษฏีสูตรโครงสร้างทางเคมีอินทรีย์
(Organic Chemistry StructuralFormula Theory)
ทฤษฏีสูตรโครงสร้างได้ถูกแบ่งไว้เป็น 2 ข้อดังนี้
1. อะตอมของธาตุในสารประกอบอินทรีย์เกิดการสร้างจานวนพันธะที่แน่นอน (พิจรณาจาก e- วงนอกสุด)
C มีอิเล็กตรอนคู่ร่วมพันธะได้4 คู่ (Tetravalent) จึงเกิดได้ 4 พันธะ
N มีอิเล็กตรอนคู่ร่วมพันธะได้3 คู่ (Trivalent) จึงเกิดได้3 พันธะ
O มีอิเล็กตรอนคู่ร่วมพันธะได้2 คู่ (Divalent) จึงเกิดได้ 2 พันธะ
H มีอิเล็กตรอนคู่ร่วมพันธะได้1 คู่ (Monovalent) จึงเกิดได้1 พันธะ
2. อะตอมคาร์บอนอาจเป็นพันธะเดี่ยว พันธะคู่ หรือ พันธะสามโดยมีข้อสังเกตว่า มีพันธะได้4 เส้น (รอบอะตอมคาร์บอนแต่ละ
อะตอม)
ไนโตรเจนอะตอมมีอิเล็กตรอนคู่ร่วมพันธะได้ 3 คู่ จึงเกิดพันธะเดี่ยว พันธะคู่ หรือพันธะสาม
ออกซิเจนอะตอมออกซิเจนมีอิเล็กตรอนคู่ร่วมพันธะได้ 2 คู่จึงเกิดพันธะเดี่ยว หรือพันธะคู่
ไฮโดรเจนและแฮโลเจนมีอิเล็กตรอนคู่ร่วมพันธะได้1 คู่จึงเกิดพันธะเดี่ยวเท่านั้น
- 10.
การเขียนสูตรโครงสร้างของสารประกอบอินทรีย์
(Line - AngleOrganic Formula)
1. สูตรโครงสร้างลิวอิส ใช้เส้นตรงแทนพันธะระหว่างธาตุ องค์ประกอบทุกพันธะภายใน
โมเลกุลของสารอินทรีย์
2. สูตรโครงสร้างแบบย่อ ไม่แสดงพันธะเดี่ยวระหว่างธาตุองค์ประกอบ แต่จะแสดงพันธะคู่
และพันธะสามในโมเลกุลของสารอินทรีย์
3. สูตรโครงสร้างแบบเส้นและมุม ใช้เส้นตรงแทนพันธะภายในโมเลกุล มุมของแส้นตรง
แสดงทิศทางของพันธะ ไม่เขียนสัญลักษณ์ของธาตุ C และ H
- 11.
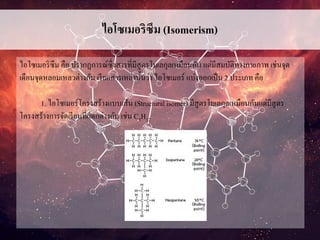
ไอโซเมอริซึม (Isomerism)
ไอโซเมอริซึม คือปรากฏการณ์ซึ่งสารที่มีสูตรโมเลกุลเหมือนกัน แต่มีสมบัติทางกายภาพ เช่นจุด
เดือนจุดหลอมเหลวต่างกัน เรียกสารเหล่านั้นว่า ไอโซเมอร์ แบ่งออกเป็น 2 ประเภท คือ
1. ไอโซเมอร์โครงสร้างแบบเส้น (Structural isomer) มีสูตรโมเลกุลเหมือนกันแต่มีสูตร
โครงสร้างการจัดเรียนที่แตกต่างกัน เช่น C5H12
- 12.
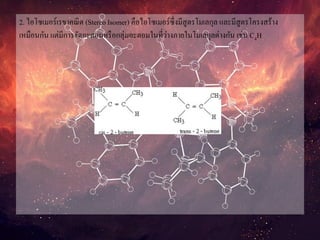
2. ไอโซเมอร์เรขาคณิต (StereoIsomer) คือไอโซเมอร์ซึ่งมีสูตรโมเลกุล และมีสูตรโครงสร้าง
เหมือนกัน แต่มีการจัดอะตอมหรือกลุ่มอะตอมในที่ว่างภายในโมเลกุลต่างกัน เช่น C4H
- 13.
- 14.
ปฏิกริยาของสารประกอบอินทรีย์
(Organic Reaction)
เกี่ยวข้องกับพันธะ การทาลายพันธะหรือการแตกพันธะโคเวเลนต์โดยเกิดผ่านสารตัวกลางที่เรียกว่า สารมัธยันตร์
(Intermediate)
ประเภทของปฏิกริยาในเคมีอินทรีย์ จาแนกตามลักษณะการเปลี่ยนแปรงของหมู่อะตอมในโมเลกุลเป็น 6
ประเภท
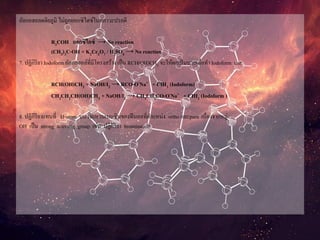
1. ปฏิกิริยาการแทนที่ (SubstitutionReaction) เกิดเฉพาะสารประกอบคาร์บอนที่อิ่มตัวแล้วเช่น Alkane, Alkylhalides
2. ปฏิกิริยาการเติม (AdditionReaction) เกิดเฉพาะสารประกอบคาร์บอนที่ยังไม่อิ่มตัวเช่น Alkane, Alkyne
3. ปฏิกิริยาการขจัดออก (EliminationReaction) เป็นการดึงเอาอะตอมใดๆออกจากโมเลกุล
4. ปฏิกิริยาการเรียงตัวใหม่ (Rearrangement Reaction) เกิดสารประกอบคาร์บอนที่จัดเรียงตัวใหม่ แต่มีสูตรโมเลกุล
เหมือนเดิมกับสารตั้งต้น
5. ปฏิกิริยาพอลิเมอไรเซชัน (PolymerizationReaction) เกิดสารประกอบคาร์บอนที่มีโมเลกุลใหญ่ขึ้นโดยมีหมู่ซ้าๆกัน
6. ปฏิกิริยาการแตกตัว (Cracking Reaction) ทาให้สารประกอบคาร์บอนโมเลกุลใหญ่มีโมเลกุลเล็กลง
- 15.
- 16.
- 17.
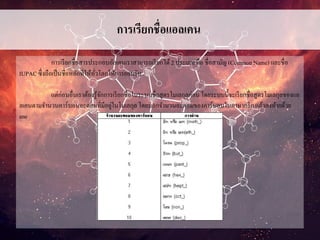
ระบบชื่อสามัญ (Common Names)
ใช้เรียกชื่อโมเลกุลเล็กๆที่ไม่ซับซ้อน ถ้าโมเลกุลใหญ่ขึ้นอาจจะต้องเติมคา
นาหน้า เช่น n- , iso- , หรือ neo- ลงไปด้วย ตัวอย่างเช่น
CH4 เรียกมีเทน
CH3 - CH2 - CH3 เรียกโพรเพน
CH3 - CH2 - CH2 - CH2 - CH3 เรียกนอร์มอลเพนเทน
CH3 - CH2 - CH2 - CH2 - CH2 - CH3 เรียกนอร์มอลเฮกเซน
- 18.
- 19.
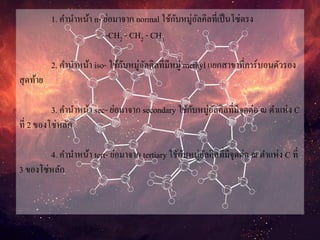
1. คานาหน้า n-ย่อมาจาก normal ใช้กับหมู่อัลคิลที่เป็นโซ่ตรง
-CH2 - CH2 - CH3
2. คานาหน้า iso- ใช้กับหมู่อัลคิลที่มีหมู่ methyl แยกสาขาที่คาร์บอนตัวรอง
สุดท้าย
3. คานาหน้า sec- ย่อมาจาก secondary ใช้กับหมู่อัลคิลที่มีจุดต่อ ณ ตาแห่ง C
ที่ 2 ของโซ่หลัก
4. คานาหน้า tert- ย่อมาจาก tertiary ใช้กับหมู่อัลคิลที่มีจุดต่อ ณ ตาแห่ง C ที่
3 ของโซ่หลัก
- 20.
การเรียกชื่อแอลเคนในระบบ IUPAC
มีหลักการเรียกชื่อดังนี้
1. ถ้าเป็นโมเลกุลสายยาวไม่มีกิ่ง ให้เรียกชื่อโครงสร้างหลักตามจานวนคาร์บอนที่มี แล้วลงท้ายด้วย - ane เช่น
CH3-CH2-CH2-CH3 มีคาร์บอน 4 อะตอมเรียกว่า บิวเทน (butane = but +ane)
CH3-CH2-CH2-CH2-CH3 มีคาร์บอน 5 อะตอมเรียกว่า เพนเทน (pentane = pent +ane)
CH3-CH2-CH2-CH2- CH2-CH3 มีคาร์บอน 6 อะตอมเรียกว่า เฮกเซน (hexane = hex +ane)
2. ถ้าเป็นโมเลกุลสายยาวที่มีกิ่ง ให้เลือกโครงสร้างหลักที่คาร์บอนต่อกันเป็นสายยาวที่สุดก่อนเรียกชื่อโครงสร้างหลักแล้วลงท้ายด้วย -
ane หลังจากนั้นจึงพิจารณาส่วนที่เป็นกิ่ง
3.ส่วนที่เป็นกิ่ง เรียกว่าหมู่แอลคิล การเรียกชื่อหมู่แอลคิลมีหลักการดังนี้
4.การนับจานวนคาร์บอนในโครงสร้างหลักเพื่อบอกตาแหน่งของหมู่แอลคิล ให้ใช้ตัวเลขที่มีค่าน้อยที่สุด
5.ตรวจดูว่ามีหมู่แอลคิลอะไรบ้าง ต่ออยู่กับคาร์บอนตาแหน่งไหนของโครงสร้างหลักให้เรียกชื่อหมู่แอลคิลนั้นโดยเขียนเลขบอก
ตาแหน่งไว้หน้าชื่อพร้อมกับมีขีด ( - ) คั่นกลาง เช่น 2-methyl, 3-methyl , 3-ethyl ฯลฯ
6.ถ้ามีหมู่แอลคิลที่เหมือนกันหลายหมู่ ให้บอกตาแหน่งทุก ๆ หมู่ และบอกจานวนหมู่ด้วยภาษาละติน เช่น di = 2, tri = 3 , tetra = 4 ,
penta = 5 , hexa = 6 , hepta = 7 , octa = 8 , nona = 9 , deca = 10 เช่น 2, 3 - dimethyl
7.ถ้ามีหมู่แอลคิลต่างชนิดมาต่อกับโคงสร้างหลัก ให้เรียกทุกหมู่ตามลาดับตัวอักษรภาษาอังกฤษ (ไม่รวมจานวนหมู่ เช่น di, tri ,
tetra) พร้อมกับบอกตาแหน่งของหมู่แอลคิลแต่ละหมู่ เช่น 3-ethyl - 2 - methyl , 3 - ethyl - 2, 3 - dimethyl
8.ชื่อของหมู่แอลคิลและชื่อโครงสร้างหลักต้องเขียนติดกัน
- 21.
- 22.
- 23.
ประโยชน์และโทษของอัลเคน
แอลเคนขนาดโมเลกุลเล็กๆเช่น CH4 ซึ่งพบในก๊าซธรรมชาติใช้เป็นเชื้อเพลิง
สาหรับเครื่องทาความร้อน หม้อต้มน้าร้อนโพรเพน และบิวเทนใช้เป็นก๊าซหุงต้มตาม
บ้านเรือน ก๊าซปิโตรเลียมเหลว (แอลพีจี) เป็นก๊าซที่ได้จากการกลั่นปิโตรเลียม แล้วบรรจุใน
ถังเหล็กภายใต้ความดันสูงทาให้ได้เป็นของเหลว ก็ใช้เป็นก๊าซหุงต้มเช่นเดียวกัน นอกจากนี้
ยังใช้แอลเคนเป็นสารตั้งต้นในอุตสาหกรรมหลายชนิดเช่น อุตสาหกรรมสารซักฟอก เส้น
ใย สารเคมีทางการเกษตรและยาปราบศัตรูพืชแอลเคนชนิดเหลวใช้เป็นตัวทาละลายพวก
โมเลกุลขนาดใหญ่ใช้ทาน้ามันหล่อลื่น นอกจากจะมีประโยชน์แล้วแอลเคนก็มีโทษ
เช่นเดียวกัน เนื่องจากสามารถละลายสารอินทรีย์ไม่มีขั้ว เช่น ไขมันและน้ามันได้เมื่อสูดดม
ไอของแอลเคนเข้าไปจะทาให้เป็นอันตรายกับเนื้อเยื่อปอดเพราะไปละลายไขมันในผนัง
เซลล์ที่ปอดนอกจากนี้แอลเคนบางชนิดที่ใช้เป็นตัวทาละลาย เช่น เอกเซน ทาให้ผิวหนัง
แห้งเจ็บ คันและแตกเพราะไปละลายน้ามันที่ผิวหนัง ทาให้ผิวหนังขาดความชุ่มชื้นจึงแห้ง
และแตก
- 24.
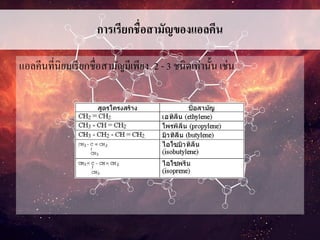
สารประกอบอัลคีน (Alkenes)
แอลคีน เป็นสารประกอบไฮโดรคาร์บอนไม่อิ่มตัวในโมเลกุลจะมี
พันธะคู่อยู่ 1 แห่ง ซึ่งทาให้มีสูตรทั่วไปเป็น CnH2n เมื่อ n = 2, 3, ……
เป็นโมเลกุลโคเวเลนต์ไม่มีขั้ว อัตราส่วนระหว่าง C:H มากกว่าของแอ
ลเคน และมีความว่องไวต่อการเกิดปฏิกิริยามากกว่าแอลเคน
การเรียกชื่ออัลคีน
แอลคีนสามารถเรียกชื่อได้ทั้ง 2 ระบบในทานองเดียวกับแอลเคน
คือชื่อสามัญและชื่อ IUPAC
- 25.
- 26.
การเรียกชื่อ IUPAC ของแอลคีน
มีหลักทั่วๆไปดังนี้
1. เลือกโครงสร้างหลักจากคาร์บอนที่ต่อกันยาวที่สุดและมีพันธะคู่ด้วย
2.เรียกชื่อโครงสร้างหลักตามจานวน C อะตอมเหมือนกับแอลเคน
3.ถ้ามีพันธะคู่เพียง 1 แห่งในโมเลกุล ให้ลงท้าย -ene ถ้ามีหลายแห่งจะต้องเปลี่ยนคาลงท้าย โดยบอกจานวน
พันธะคู่ที่มีทั้งหมดเป็น ภาษาละติน
มีพันธะคู่ 2 แห่ง คาลงท้ายเป็น -adiene
มีพันธะคู่ 3 แห่ง คาลงท้ายเป็น -atriene
4.การนับจานวนคาร์บอนในโครงสร้างหลักให้นับจากด้านที่จะทาให้ตาแหน่งของพันธะคู่เป็นเลขน้อยที่สุด
5.เนื่องจากแอลคีนมีไอโซเมอร์หลายชนิด ดังนั้นต้องบอกตาแหน่งของพันธะคู่ให้ถูกต้องด้วย โดยบอก
ตาแหน่งพันธะคู่ด้วยเลขตาแหน่งแรก (ตัวเลขน้อยกว่า) ของพันธะคู่6.ถ้ามีหมู่แอลคิลมาเกาะที่โครงสร้างหลัก
ให้เรียกชื่อแบบเดียวกับกรณีแอลเคน
- 27.
สมบัติทางกายภาพ (Physical Properties)
1.แอลคีนโมเลกุลเล็กๆ(มี C 2-4 อะตอม) จะเป็นก๊าซ เมื่อขนาดโมเลกุลใหญ่ขึ้น (มีจานวนคาร์บอนมากขึ้น
เป็น 5 - 18 อะตอม) จะเป็นของเหลว และถ้าขนาดใหญ่กว่านี้จะเป็นของแข็ง
2.เป็นโมเลกุลโคเวเลนต์ไม่มีขั้ว จึงไม่ละลายในตัวทาละลายมีขั้ว เช่น น้า แต่ละลายได้ดีในตัวทาละลายไม่มี
ขั้วเช่น เบนซีน โทลูอีน
3.ไม่นาไฟฟ้าในทุกสถานะ
4.มีกลิ่นเฉพาะตัว เช่น C2H4 เมื่อดมมากๆ อาจสลบได้
5.มีความหนาแน่นน้อยกว่าน้า (ความหนาแน่นสูงสุดไม่เกิน 0.8 g/cm3) เมื่อมวลโมเลกุลเพิ่มขึ้น ความ
หนาแน่นจะเพิ่มขึ้น (ตารางที่ 10.15)
6.จุดเดือดจุดหลอมเหลวต่าเพราะมีแรงยึดเหนี่ยวระหว่างโมเลกุลเพียงชนิดเดียว คือแรงแวนเดอร์วาลส์ เมื่อ
มวลโมเลกุลเพิ่มขึ้นหรือเมื่อจานวน อะตอมของคาร์บอนเพิ่มขึ้น จุดเดือดจะเพิ่มขึ้น ทั้งนี้เพราะแรงแวน
เดอร์วาลส์เพิ่มขึ้น
7.จุดเดือดและจุดหลอมเหลวของแอลคีนที่มีคาร์บอนเท่ากับแอลเคนและมีโครงสร้างเหมือนกันจะต่ากว่าของ
แอลเคน
- 28.
ปฏิกริยาของสารประกอบอัลคีน
(Reaction of Alkenes)
1.ปฏิกิริยาการเผาไหม้
แอลคีนติดไฟได้ง่ายเป็นปฏิกิริยาคายความร้อนที่บรรยากาศปกติจะเกิดเขม่าหรือมีควัน แต่ถ้าเผาในบริเวณ
ที่ มีออกซิเจนจานวนมากเกินพอจะเกิดปฏิกิริยาสมบูรณ์ไม่มีเขม่าได้ CO2 และ H2O ซึ่งเขียนเป็นสมการทั่วไปได้ใน
ทานองเดียวกับแอลเคน
2.ปฏิกิริยาการเติมหรือปฏิกิริยาการรวมตัว (addition reaction)
แอลคีนสามารถเกิดปฏิกิริยาการเติมได้ง่ายตรงบริเวณพันธะคู่
3. ปฏิกิริยาการเกิดพอลิเมอร์ (porimerisation reaction)
เป็นปฏิกิริยารวมตัวอีกแบบหนึ่งเกิดจากแอลคีนโมเลกุลเล็กๆ หลายๆ โมเลกุลเกิดปฏิกิริยาการรวมตัวเป็น
โมเลกุลใหญ่ ปฏิกิริยาการเกิด พอลิเมอร์จะเกิดขึ้นเมื่อใช้ตัวเร่งปฏิกิริยาความดันและความร้อนจะเกิดตรงบริเวณ
พันธะคู่เนื่องจากส่วนนี้มีพลังงานสูงจึงว่องไวในการเกิดปฏิกิริยา กว่าส่วนอื่นๆ
แอลคีนโมเลกุลเล็กๆ ที่ใช้เป็นสารตั้งต้นเรียกว่า มอนอเมอร์ (monomer) เช่น CH2 = CH2 หรือ CH3 - CH = CH2 เป็น
ต้น
โมเลกุลใหญ่ที่เกิดขึ้นเรียกว่า พอลิเมอร์ (polymer) ซึ่งมีชื่อเรียกต่างๆกันตามชนิดของมอนอเมอร์ เช่น
ถ้าใช้เอทิลีนเป็นมอนอเมอร์ จะเรียกว่า พอลิเอทิลีน
ถ้าใช้โพรพิลีนเป็นมอนอเมอร์ จะเรียกว่า พอลิโพรพิลีน
- 29.
- 30.
สารประกอบอัลไคน์ และอัลคาไดอีน
(Alkynes andAlkadienes)
แอลไคน์ เป็นสารประกอบไฮโดรคาร์บอนไม่อิ่มตัวเหมือนแอลคีน ใน
โมเลกุลของแอลไคน์จะต้องมีพันธะสามระหว่าง C กับ C (C C) ถ้ามีพันธะ
สาม 1 แห่ง จะมีสูตรทั่วไปเป็น CnH2n - 2 เมื่อ n = 2, 3, ….สารตัวแรกในอนุกรม
แอลไคน์ คือ C2H2 เรียกว่าอะเซติลีน (acetylene) หรือ อีไทน์ (ethyne) ลักษณะโมเลกุล
เป็นเส้นตรงอยู่ในระนาบเดียวกันมุมระหว่างพันธะ 1800
- 31.
การเรียกชื่ออัลไคน์
ก. ชื่อสามัญ ใช้เรียกชื่อแอลไคน์ในโมเลกุลเล็กๆโดยเรียกเป็น
อนุพันธ์ของอะเซทิลีน ให้โครงสร้างของอะเซทิลีนเป็นหลักและถือว่าส่วน
ที่ต่ออยู่กับ C C เป็นหมู่แอลคิล การเรียกชื่อสามัญให้เรียกชื่อหมู่แอลคิล
ก่อนแล้วลงท้ายด้วยอะเซทิลีน ตัวอย่างเช่น
ข. ชื่อ IUPAC ใช้เรียกโมเลกุลที่ใหญ่และซับซ้อนได้โดยใช้
หลักการอย่างเดียวกับการเรียกชื่อแอลคีน แต่เปลี่ยนคาลงท้ายเป็น - yne
เลือกโครงสร้างหลักยาวที่สุดที่มีพันธะสามก่อน บอกตาแหน่งของพันธะ
สามด้วยเลขที่น้อยที่สุด หลังจากนั้นจึงจะพิจารณาส่วนอื่นๆ ที่มาต่อกับ
โครงสร้างหลัก
- 32.
- 33.
การเตรียมอัลไคน์ (Synthesis ofAlkynes)
1.dehydrohalogenation of alkylhalide โดยนา alkyl dihalide ทาปฏิกิริยา
กับ KOH หรือ NaOH ในแอลกอฮอล์
2.dehalogenation of tetrahalide โดยนา tetrahalide ทาปฏิกิริยากับ Zn
- 34.
- 35.
ปฏิกิริยาของอัลไคน์ (Reaction ofAlkynes)
แอลไคน์มีพันธะสามซึ่งเป็นสารประกอบไม่อิ่มตัว จึงเกิดปฏิกิริยาการเติมคล้าย
แอลคีนปฏิกิริยาของแอลไคน์ที่สาคัญ ได้แก่
1. ปฏิกิริยาการเผาไหม้ ถ้าเผาไหม้ในบรรยากาศปกติหรือในบริเวณที่มี O2 น้อยจะให้
เขม่า (มากกว่าแอลคีน) แต่ถ้าเผาในบริเวณที่มีออกซิเจนมากเกินพอ จะไม่ให้เขม่าเมื่อ
เกิดปฏิกิริยาสมบูรณ์จะได้ H2O และ CO2 ซึ่งเขียนเป็นสมการทั่วไปเหมือนแอลเคนและ
แอลคีน
2. ปฏิกิริยาการเติม จะเกิดที่บริเวณพันธะสาม (เหมือนกับแอลคีนซึ่งเกิดที่พันธะคู่)
ก. ปฏิกิริยาการเติมไฮโดรเจน (hydrogenation)
โดยมี Pt, Ni, หรือ Pd เป็นตัวเร่งปฏิกิริยาจะได้ผลิตภัณฑ์เป็นแอลคีนหรือแอ
ลเคนตามปริมาณของ H2 ที่ใช้ ถ้า 1 โมลของแอลไคน์รวมตัวกับ H2 1 โมลจะได้แอ
ลคีน แต่ถ้าใช้ H2 โมล จะได้แอลเคน
- 36.
ข. ปฏิกิริยาการเติมเฮโลเจน (halogenation)
ปฏิกิริยานี้ไม่ต้องใช้ตัวเร่งปฏิกิริยาหรือไม่ต้องใช้แสงสว่างเข้าช่วยและ
ไม่มีก๊าซ HX เกิดขึ้น ผลิตภัณฑ์ที่เกิดขึ้น ขึ้นอยู่กับปริมาณของแอลไคน์และเฮโล
เจน
ถ้าใช้ Cl2 เรียกว่า คลอรีเนชัน (chlorination)
ถ้าใช้ Br2 เรียกว่า โบรมิเนชัน (bromination)
ค. ปฏิกิริยาการเติม HX
ง. ปฏิกิริยาการเติมน้า โดยใช้ HgSO4 และ H2SO4 เป็นตัวเร่งปฏิกิริยา
3. ปฏิกิริยาออกซิเดชัน โดยแอลไคน์ฟอกจางสีของ KMnO4 ได้
4. reaction of terminal alkyne
แอลไคน์ที่มีโครงสร้างเป็น R - C = CH คือพันธะสามอยู่ปลายสุดของ
โมเลกุล จะทาปฏิกิริยากับโลหะบางชนิดได้
5. ปฏิกิริยาการเกิดโพลิเมอร์
- 37.
ประโยชน์ของอัลไคน์
ส่วนใหญ่เป็นประโยชน์ของอะเซทิลีน (C2H2) ดังนี้
1.ใช้C2H2เป็นเชื้อเพลิงโดยผสมกับ O2 เรียกว่า Oxyacetylene ให้ความร้อนสูง
มาก (อุณหภูมิประมาณ 3000 0C ) จึงใช้ในการเชื่อมโลหะ
2.ใช้C2H2 เป็นสารตั้งต้นในการเตรียมสารอื่นๆ เช่น
ก. เตรียมพลาสติก polyvinyl chloride (P.V.C) , polyvinyl ether, polyvinyl
acetate
ข. เตรียม acetylene tetrachloride
(C2H2Cl4) และ trichloroacetylene หรือ trilene (C2HCl3) ซึงใช้ประโยชน์ในการซักแห้ง
ค. เตรียมสารอื่นๆ เช่น acetaldehyde, acetone และ acetic acid
ง. ใช้เร่งการออกดอกของพืชบางชนิด เช่น สับปะรด
- 38.
- 39.
- 40.
- 41.
- 42.
- 43.
- 44.
ข. ระบบ IUPACการเรียกชื่อแอลกอฮอล์ในระบบนี้คล้ายกับการเรียกชื่อสารอินทรีย์
อื่นท่กล่าวมาแล้ว คือ
1. เลือกโครงสร้างหลักที่มีคาร์บอนต่อกันยาวที่สุด และมีหมู่ –OH อยู่ด้วย
2. บอกตาแหน่ง –OH ด้วยเลขที่มีค่าน้อยที่สุด
3. ชื่อโครงสร้างหลักให้เรียกตามจานวนอะตอม C แล้วลงท้ายเสียงเป็น –อา
นอล (–anol)
- 45.
สมบัติทางกายภาพ (Physical Properties)
1.alcohol ที่มี C-1-3 อะตอมละลายน้าได้ดี แต่ไม่นาไฟฟ้า แต่ C อะตอมยิ่งมาก
จะยิ่งละลายน้าได้น้อยจนถึงไม่ละลาย
2. มีจุดหลอมเหลวและจุดเดือดสูงกว่าไฮโดรคาร์บอนที่มีมวลโมเลกุลใกล้เคียง
กัน เนื่องจากมีแรงยึดเหนี่ยวระหว่างโมเลกุล เป็นพันธะไฮโดรเจนและแรงวัน
เดอร์วาลส์
3. มีจุดเดือดต่ากว่าจุดเดือดของกรดอินทรีย์ที่มีมวลโมเลกุลเท่ากัน เนื่องจาก
พันธะไฮโดรเจนในกรดอินทรีย์แรงกว่า
4. มีจุดเดือดสูงขึ้น เมื่อมีมวลโมเลกุลเพิ่มขึ้น และสารที่เป็นไอโซเมอร์กัน โซ่
ตรงจะมีจุดเดือดสูงกว่าโซ่กิ่ง และ alcohol ที่มี C-3 อะตอมขึ้นไปจะมีไอโซ
เมอร์
- 46.
ปฏิกิริยาของแอลกอฮอล์ (Synthesis ofAlcohols)
1.การเกิดเกลือของแอลกอฮอล์และก๊าซไอโดรเจนเมื่อแอลกอฮอล์ทาปฏิกิริยากับโลหะสาหรับแอลกอฮอล์ปฐมภูมิจะ
เกิด ปฏิกิริยาได้เร็วมากที่สุด
เช่น R-OH + Na → R-O -Na+ + H2
CH3CH2CH2CH2OH+ Na → CH3CH2CH2CH2O-Na+ + H2
2. ปฏิกิริยาแทนที่ -OH ด้วยลูกัสรีเอเจนต์HCl/ZnCl2(anhydrous) สาหรับแอลกอฮอล์ตติยภูมิจะเกิดการแทนที่ได้เร็วมาก
ที่สุด เช่น
R-OH + HCl/ZnCl2(anhydrous) → R-Cl+ H2O
(CH3)3C-OH+ HCl/ZnCl2→ (CH3)3C-Cl+ H2 O
3. ปฏิกิริยาของกรดคาร์บอกซิลิกกับไทโอนิลคลอไรด์(SOCl2)ให้แอซิดคลอไรด์เช่น
R-OH + SOCl2 → RCl+ S2O + HCl
CH3CH2CH2CH2OH+ SOCl2 → CH3CH2CH2CH2Cl+ S2O + HCl
- 47.
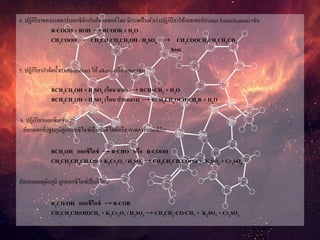
4. ปฏิกิริยาของกรดคาร์บอกซิลิกกับอัลกอฮอล์โดย มีกรดเป็นตัวเร่งปฏิกิริยาให้เอสเทอร์(FisherEsterification) เช่น
R-COOH + ROH → RCOOR + H2O
CH3COOH + CH3CH2CH2CH2OH / H2SO4 → CH3COOCH2CH2CH2CH3
heat
5. ปฏิกิริยากาจัดน้า(Dehydration) ให้ alkene หรือ ether เช่น
RCH2CH2OH + H2SO4 (ร้อน มาก) → RCH=CH2 + H2O
RCH2CH2OH + H2SO4 (ร้อน ปานกลาง) → RCH2CH2OCH2CH2R + H2O
6. ปฏิกิริยาออกซิเดชัน
อัลกอฮอล์ปฐมภูมิถูกออกซิไดซ์เป็นอัลดีไฮด์หรือ กรดคาร์บอกซิลิก
RCH2OH ออกซิไดซ์ → R-CHO หรือ R-COOH
CH3CH2CH2CH2OH + K2Cr2O7 / H2SO4 → CH3CH2CH2COOH + K2SO4 + Cr2SO4
อัลกอฮอลทุติยภูมิ ถูกออกซิไดซ์เป็นคีโตน
R2CH-OH ออกซิไดซ์ → R-COR
CH3CH2CH(OH)CH3 + K2Cr2O7 / H2SO4 → CH3CH2-CO-CH3 + K2SO4 + Cr2SO4
- 48.
อัลกอฮอลตติยภูมิ ไม่ถูกออกซิไดซ์ในสภาวะปรกติ
R3COH ออกซิไดซ์→ No reaction
(CH3)3C-OH + K2Cr2O7 / H2SO4 → No reaction
7. ปฏิกิริยา Iodoform อัลกอฮอล์ที่มีโครงสร้าง เป็น RCH(OH)CH3 จะให้ผลเป็นบวกเมื่อทา Iodoform test
RCH(OH)CH3 + NaOH/I2 → RCO-O-Na+ + CHI3 (Iodoform)
CH3CH2CH(OH)CH3 + NaOH/I2 → CH3CH2CO-O-Na+ + CHI3 (Iodoform )
8. ปฏิกิริยาแทนที่ H-atom บนวงแหวนเบนซินของฟีนอลที่ตาแหน่ง ortho และpara เนื่องจากหมู่
OH เป็น strong activatig group เช่น ปฏิกิริยา bromination
- 49.
อีเทอร์ (Ethers)
อีเทอร์เป็นสารประกอบอินทรียที่มีหมู่ออกซี่ (-O-)เป็นหม่ฟังก์ชัน
และ มีสูตรทั่วไปคือ R-O-R' เมื่อหมู่ R คือหมู่แอลคิล (Alkyl group)
การเรียกชื่ออีเทอร์ (Ethers)
ก.เรียกชื่อสามัญของ อีเทอร์ (Ethers) ให้เรียกหมู่อัลคิลที่ต่ออยู่กับ O-
atom แล้วลงท้าย ด้วย ether เช่น
ethyl methyl ether (CH3CH2OCH3)
diethyl ether (CH3CH2OCH2CH3)
ข. เรียกตามระบบ IUPAC ให้เรียกเป็นหมู่ prefix ว่า หมู่ alkoxy-
- 50.
- 51.
ปฎิกิริยาของ Ether (Reactionsof Ethers)
อีเทอร์ไม่ว่องไวต่อปฏิกิริยา ทางเคมี สาหรับปฏิกิริยาที่เกิดกับอีเทอร์ได้แก่
1. ปฏิกิริยา ของอีเทอร์กับ HI หรือ HBr ที่เข้มข้นและร้อน เช่น
ROR + HI RI + ROH และถ้าใช้HIมากเกินพอ (excess) ROHจะเกิดปฏิกิริยาต่อเป็น RI
ROH + HI RI + H2O
เช่น (CH3)3C-O-C(CH3)3 + HBr มากเกินพอ(excess) (CH3)3C-Br (2 moles)
2. ปฏิกิริยา ของอีเทอร์กับออกซิเจน ให้สารประกอบ hydroperoxide (ROOH)
เช่น CH3-O-CH3 + O2 มากเกินพอ(excess) CH3-O-CH2-O-O-H
- 52.
แอลดีไฮด์ และคีโตน (Aldehydesand Ketones)
แอลดีไฮด์(Aldehyde) เป็นสารประกอบอินทรีย์ที่หมู่ฟังก์ชันเป็น
หมู่คาร์บอกซาลดีไฮด์ (Carboxaldehyde :หรือ –CHO) มีสูตรทั่วไป
เป็น หรือ RCHO หรือ CnH2nO เมื่อ R , R’ เป็นหมู่แอลคิลหรือหมู่แอริล
- 53.
การเรียกชื่อ (Nomenclature)
ก. ชือสามัญ(Common Name)
แอลดีไฮด์เรียกโดยเปลี่ยนคาลงท้าย -ic acid หรือ -oic acid ของกรดอินทรีย์ที่สอดคล้องเป็น -aldehyde และ
ให้ตาแหน่ง Cที่มีหมู่ฟอร์มิลเกาะอยู่เป็น a
ข. ชื่อ IUPAC
แอลดีไฮด์เรียกโดยเลือกสาโซ่ที่ยาวที่สุดที่มีหมู่ formyl อยู่ด้วยเป็นสายโซ่หลักโดยเปลี่ยน e ท้ายชื่อ
alkane เป็น -al
- 54.
สมบัติของแอลดีไฮด์
1. แอลดีไฮด์จึงเป็นโมเลกุลมีขั้ว เช่นเดียวกับน้า แรงยึดเหนี่ยวระหว่างโมเลกุล
จึงเป็นแรงดึงดูดระหว่างขั้ว แต่สามารถเกิดพันธะไฮโดรเจนกับโมเลกุลของน้าได้โดยเกิด
สลับกับโมเลกุลของน้า (Associated hydrogen bond) การละลายน้าจะลดลงเมื่อจานวน
อะตอมคาร์บอนเพิ่มขึ้นเนื่องจากมีส่วนที่ไม่มี ขั้วมากขึ้น
2. จุดเดือดของแอลดีไฮด์มี แนวโน้มเพิ่มขึ้นตามจานวนอะตอมคาร์บอน
เนื่องจากการเพิ่มขึ้นของจานวนอะตอมคาร์บอนทาให้มวลโมเลกุลสูงขึ้น เป็นผลให้แรง
แวนเดอร์วาลส์สูงขึ้น คีโตน (Ketone) เป็นสารประกอบอินทรีย์ที่มีหมู่ฟังก์ชันเป็นหมู่คาร์
บอ นิล (Carbonyl group : หรือ –CO–)สูตรทั่วไป ของคีโตน
คือ หรือ RCOR’ หรือ CnH2nO เมื่อ R , R’ เป็นหมู่แอลคิลหรือหมู่ แอริลคีโตนเป็นไอ
โซเมอร์โครง สร้างกับแอลดีไฮด์โดยคีโตนตัวแรกจะเริ่มต้นที่คาร์บอน 3 อะตอม
- 55.
การเรียกชื่อ (Nomenclature)
ก. ชือสามัญ(Common Name)
คีโตน เรยกชื่อหมู่ทั้งสองที่เกาะอยู่บนC ของหมู่ Carbonyl ก่อน โดยเรียงตามลาดับอักษรแล้วลงท้าว่า
ketone
ข. ชื่อ IUPAC
คีโตน เรียกโดยเลือกสายโซ่หลักที่มี C ของหมู่ Carbonyl อยู่ด้วยในสายโซ่หลักโดยเปลี่ยน e ท้ายชื่อ alkane
เป็น - one และให้ตาแหน่องของC ในหมู่ Carbonyl เป็นตัวเลขที่น้อยที่สุด
- 56.
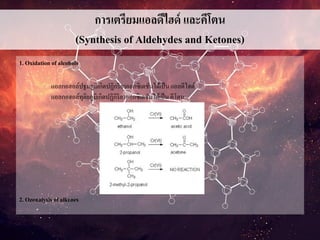
การเตรียมแอลดีไฮด์ และคีโตน
(Synthesis ofAldehydes and Ketones)
1. Oxidation of alcohols
แอลกอฮอล์ปฐมภูมิเกิดปฏิกริยาออกซิเดชันได้เป็น แอลดีไฮด์
แอลกอฮอล์ทุติยภูมิเกิดปฏิกิริยาออกซิเดชันได้เป็นคีโตน
2. Ozonalysis of alkenes
- 57.
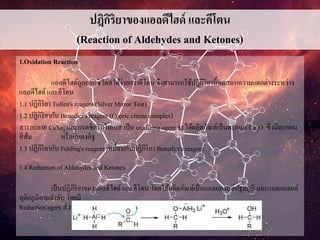
ปฎิกิริยาของแอลดีไฮด์ และคีโตน
(Reaction ofAldehydes and Ketones)
1.Oxidation Reaction
แอลดีไฮด์ถูกออกซิไดส์ได้ง่ายกว่าคีโตน จึงสามารถใช้ปฎิกิริยานี้ทดสอบความแตกต่างระหว่าง
แอลดีไฮด์ และคีโตน
1.1 ปฏิกิริยา Tollen's reagent (Silver Mirror Test)
1.2 ปฎิกิริยากับ Benedict's reagent (Cupric citrate complex)
สารละลาย CuSo4 และกรดซิตริกในเบส เป็น oxidizing agent จะได้ผลิตภัณท์เป็นตะกอน Cu2O ซึ่งมีตะกอน
สีส้ม หรือสีแดงอิฐ
1.3 ปฏิกิริยากับ Fehling's reagent เหมื่อนกับปฏิกิริยา Benedict's reagent
1.4 Reduction of Aldehydes and Ketones
เป็นปฏิกิริยาของแอลดีไฮด์ และคีโตน โดยได้ผลิตภัณท์เป็นแอลกอฮอล์ปฐมภูมิ และแอลกอฮอล์
ทุติยภูมิตามลาดับ โดยมี
Reduction agent ส่วนใหญ่คือ LiAlH4 หรือ NaBH4