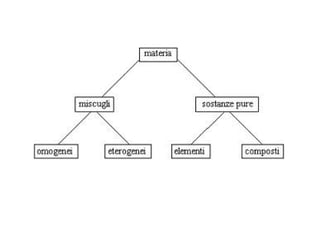
Il documento descrive la natura dei miscugli, distinguendo tra omogenei ed eterogenei e i metodi per separarli, come filtrazione, decantazione e setacciatura. Viene inoltre spiegata la concentrazione delle soluzioni, definendo termini come soluzione satura, concentrata e diluita, e i metodi di separazione delle soluzioni, come cristallizzazione, distillazione e cromatografia. Infine, si illustrano fattori che influenzano la solubilità e le tecniche per preparare soluzioni concentrate.