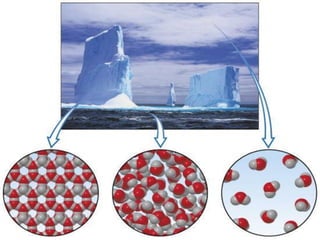
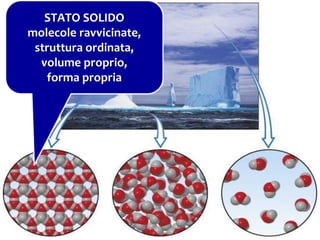
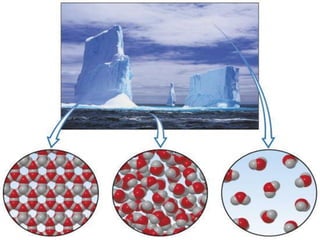
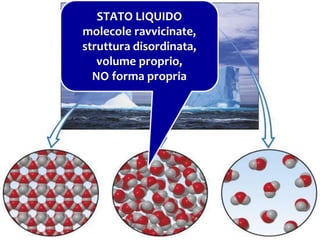
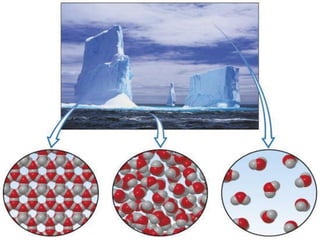
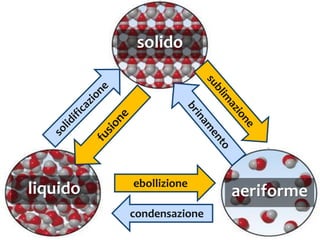
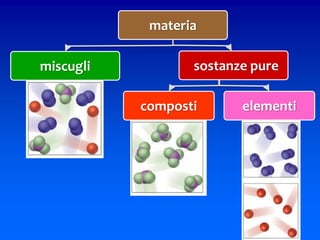
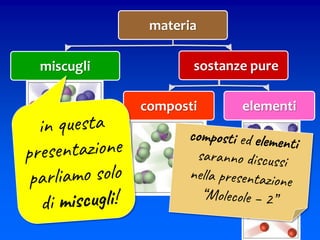
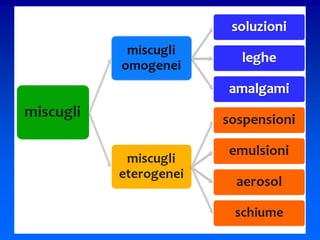
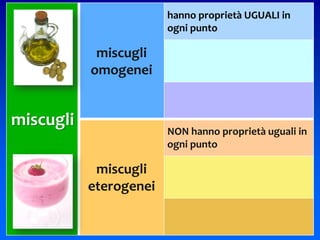
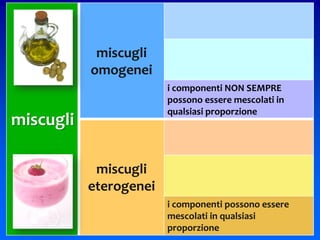
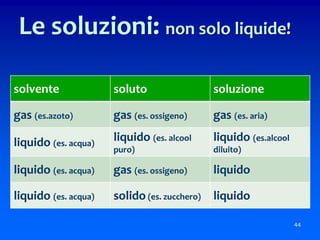
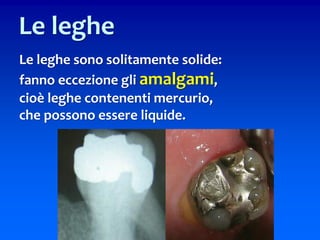
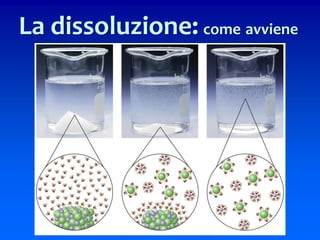
Il documento descrive gli stati di aggregazione della materia (solido, liquido, gassoso) e le caratteristiche dei miscugli, distinguendo tra omogenei e eterogenei. Inoltre, esplora la definizione di sistemi aperti, chiusi e isolati, nonché metodi di separazione per i componenti dei miscugli, come filtrazione, distillazione e cromatografia. Infine, viene trattata la dissoluzione e la concentrazione delle soluzioni, con esempi di applicazione pratica.