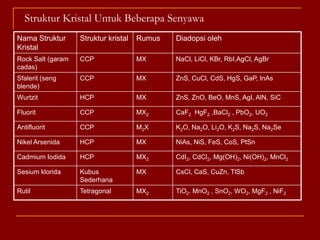
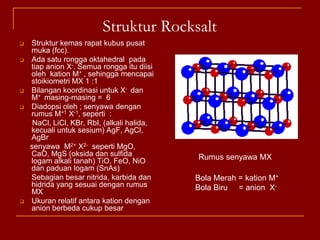
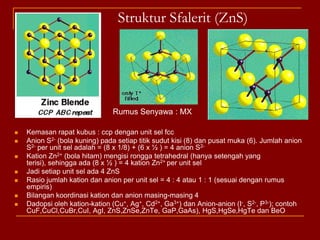
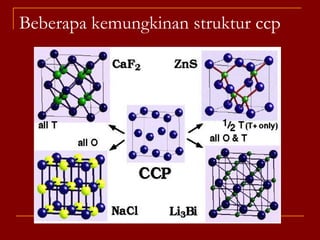
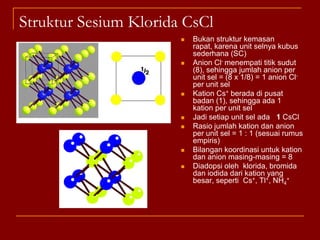
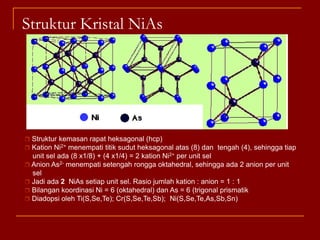
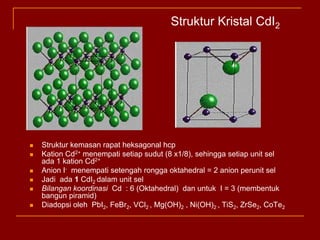
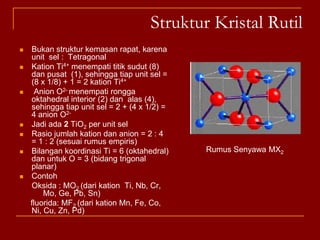
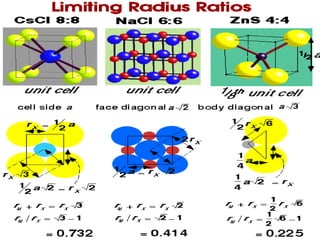
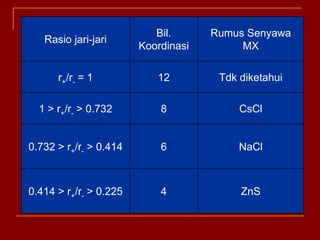
Struktur kristal ionik terdiri dari kation dan anion yang teratur dalam susunan tiga dimensi, dengan ion berlawanan muatan berselingan untuk mencapai interaksi elektrostatik maksimal. Struktur dipengaruhi oleh muatan dan ukuran ion, serta kestabilan dicapai melalui koordinasi antar ion. Beberapa struktur umum meliputi kemasan rapat kubus, heksagonal, dan variasi lainnya.