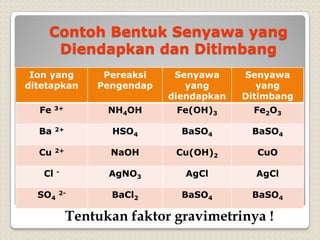
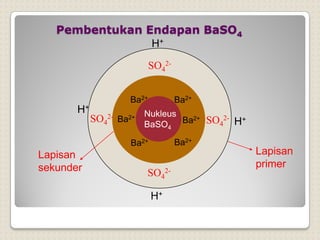
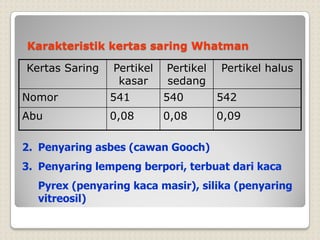
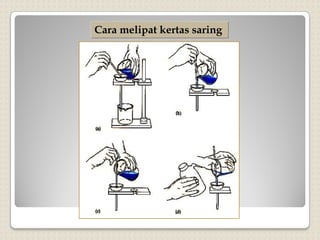
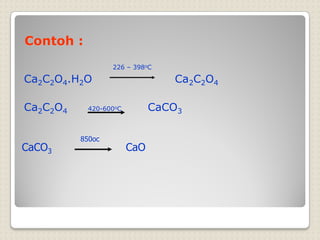
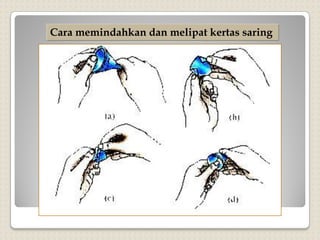
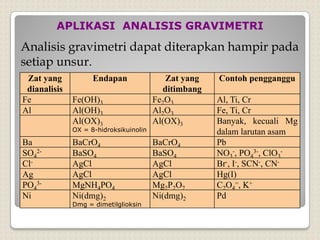
Metode analisis kimia yang didasarkan pada pengukuran massa analit atau senyawa. Terdapat beberapa metode gravimetri konvensional seperti cara gravimetri, cara volumetri, dan metode fisiko-kimia modern seperti cara elektrokimia, spektrofotometri, dan kromatografi. Metode gravimetri meliputi proses pengendapan, pencucian, pengeringan, dan penimbangan endapan untuk menentukan massa analit.