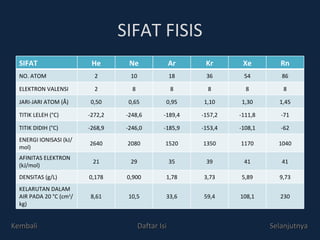
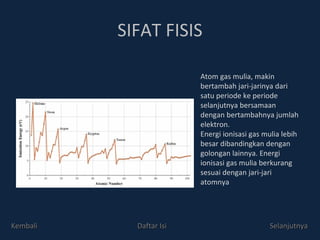
Gas mulia adalah unsur golongan VIIIA yang sangat stabil dengan konfigurasi elektron penuh. Meskipun awalnya dianggap inert, beberapa senyawa gas mulia telah berhasil dibuat, seperti senyawa xenon pada tahun 1962. Sifat fisis dan kimia gas mulia mencakup ketidakberwarnaan, ketidakberbauan, dan kemampuan rendah untuk bereaksi, kecuali dengan unsur sangat elektronegatif.