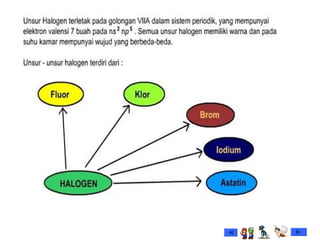
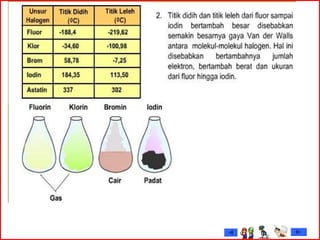
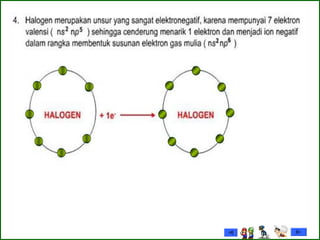
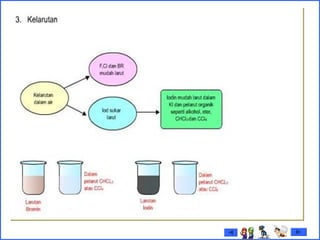
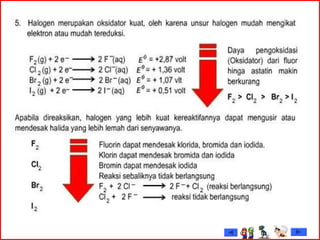
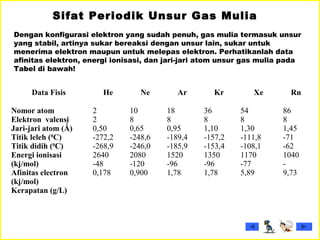
Dokumen tersebut membahas tentang gas mulia dan halogen, dua golongan unsur kimia yang memiliki sifat khusus. Ia menjelaskan sifat fisik dan kimia gas mulia seperti titik leleh dan didih, afinitas elektron serta kegunaannya. Dokumen juga menjelaskan sifat periodik, fisik dan kimia dari unsur-unsur halogen seperti jari-jari atom, energi ionisasi dan kereaktifannya.






![ARGON
Keterangan Umum Unsur
Nama, Lambang, Nomor atom argon, Ar, 18
Deret kimia gas mulia
Golongan, Periode, Blok 18, 3, p
Penampilan
Massa atom 39,948(1) g/mol
Konfigurasi elektron [Ne] 3s2
3p6
Jumlah elektron tiap kulit 2, 8, 8
Ne
↑
Ar
↓
Kr
klorin ← argon → -18](https://image.slidesharecdn.com/kelompok3-161025115903/85/Kelompok-3-gas-mulia-halogen-10-320.jpg)
![KRIPTON
2, 8, 18, 8Jumlah elektron tiap kulit
[Ar] 3d10
4s2
4p6
Konfigurasi elektron
83.798(2) g/molMassa atom
Penampilan
18, 4, pGolongan, Periode, Blok
noble gasesDeret kimia
krypton, Kr, 36Nama, Lambang, Nomor atom
Keterangan Umum Unsur](https://image.slidesharecdn.com/kelompok3-161025115903/85/Kelompok-3-gas-mulia-halogen-11-320.jpg)

![RADON
Keterangan Umum Unsur
Nama, Lambang,Nomor atom radon, Rn, 86
Deret kimia gas mulia
Golongan, Periode, Blok 18, 6, p
Penampilan tak berwarna
Massa atom (222) g/mol
Konfigurasi elektron [Xe] 4f14
5d10
6s2
6p6
Jumlah elektron tiap kulit 2, 8, 18, 32, 18, 8
Radon adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Rn dan
nomor atom 86. Radon juga termasuk dalam kelompok gas mulia dan beradioaktif. Radon
terbentuk dari penguraian radium. Radon juga gas yang paling berat dan berbahaya bagi
kesehatan. Rn-222 mempunyai waktu paruh 3,8 hari dan digunakan dalam radioterapi.
Radon dapat menyebabkan kanker paru paru, dan bertanggung jawab atas 20.000 kematian
di Uni Eropa setiap tahunnya](https://image.slidesharecdn.com/kelompok3-161025115903/85/Kelompok-3-gas-mulia-halogen-13-320.jpg)






![+1
+5, +7
+ 1
+5, +7
+ 1, +3
+5, +7
-1
9. Bilangan Oksidasi Senyawa
Halogen
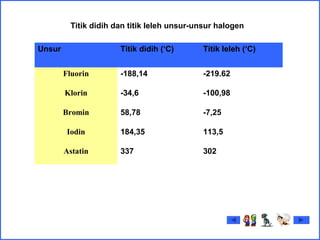
18358-34-188.28. Suhu Didih (0o)
114.0-72-101.0-216.67. Suhu Lebur (0o)
6. Potensial Reduksi (Eored > 0)
5. Keelektronegatifan
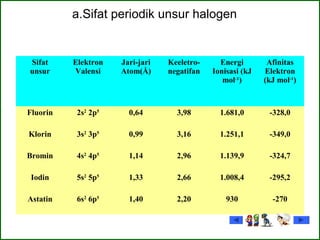
4. Energi Ionisasi dan Afinitas
Elektron
3. Jari-jari Atom
2. Massa Atom
[X] ns2 , np51. Konfigurasi elektron
53I 35Br17Cl9F
Iodium BromKlorFluor
UNSUR
HUBUNGAN ANTARA JARI – JARI ATOM, AFINITAS ELEKTRON, DAN
KEREAKTIFAN HALOGEN](https://image.slidesharecdn.com/kelompok3-161025115903/85/Kelompok-3-gas-mulia-halogen-22-320.jpg)