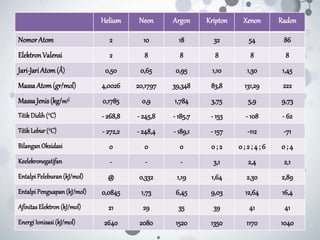
Gas mulia adalah unsur golongan VIIIA yang sangat stabil karena konfigurasi elektronnya yang terisi penuh, membuatnya sangat sulit bereaksi. Meskipun awalnya dianggap benar-benar inert, saat ini telah ditemukan berbagai senyawa gas mulia akibat pertambahan jari-jari atom yang mengurangi daya tarik intinya terhadap elektron. Gas mulia banyak digunakan dalam industri.


![Konfigurasi elektron gas mulia
Unsur Nomor Atom Konfigurasi Elektron
He 2 1s2
Ne 10 [He] 2s2 2p6
Ar 18 [Ne] 3s2 3p6
Kr 36 [Ar] 4s2 3d10 4p6
Xe 54 [Kr] 5s2 4d10 5p6
Rn 86 [Xe] 6s2 5d10 6p6
Unsur Nomor Atom Konfigurasi Elektron
He 2 1s2
Ne 10 [He] 2s2 2p6
Ar 18 [Ne] 3s2 3p6
Kr 36 [Ar] 4s2 3d10 4p6
Xe 54 [Kr] 5s2 4d10 5p6
Rn 86 [Xe] 6s2 5d10 6p6](https://image.slidesharecdn.com/gasmulia-141025082002-conversion-gate02-161114030133/85/Gasmulia-3-320.jpg)



![• Reaksi-Reaksi Gas Mulia
Gas Mulia adalah gas yang sudah memiliki 8
elektron valensi dan memiliki kestabilan yang tinggi.
Tetapi gas mulia pun masih dapat bereaksi dengan
atom lain. Karena sebenarnya tidak semua sub kuit
pada gas mulia terisi penuh.
Contoh:
Ar : [Ne] 3s2 3p6
Sebenarnya atom Ar masih memiliki 1 Sub kulit yang
masih kosong yaitu sub kulit d
jadi
Ar : [Ne] 3s2 3p6 3d0
jadi masih bisa diisi oleh atom-atom lain.](https://image.slidesharecdn.com/gasmulia-141025082002-conversion-gate02-161114030133/85/Gasmulia-8-320.jpg)
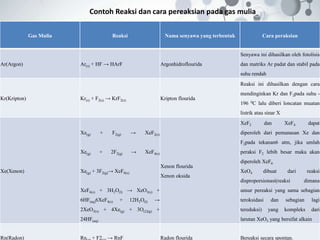












![Cara memperoleh
• Kripton (Kr) dapat direaksikan dengan Flour (F2) dan menghasilkan Kripton
difluorida (KrF2) dengan rumus molekul:
• Kr(s) + F2 (s) → KrF2 (s)
• Reaksi ini dihasilkan dengan cara mendinginkan Kr dan F2 pada suhu -196
0C lalu diberi loncatan muatan listrik atau sinar X. Dari kira-kira selusin
senyawaan kripton yang dikenal, semuanya merupakan garam kompleks
yang diturunkan dari KrF2. Salah satu contoh pembentukan garam adalah:
• KrF2 + SbF5 → KrF+ + SbF6
-
• Lalu, pada tahun yang sama, KrF4 dilaporkan oleh Grosse, tetapi kemudian
ditemukan kekeliruan. Ada juga senyawa yang belum diverifikasi, yaitu
barium garam dari asam karboksilat Kripton. Ion poliatomik ArKr + dan
KrH+ telah diteliti dan terbukti untuk KrXe atau KrXe+. Senyawa Kripton
berikatan dengan atom-atom selain fluor juga telah ditemukan. Reaksi
KrF2 dengan B(OTeF5)3 menghasilkan senyawa yang tidak stabil, Kr(OTeF5)2,
yang berisi ikatan Kripton-oksigen. Ikatan Kripton-nitrogen ditemukan
pada kation [HC≡N–Kr–F]+, dihasilkan oleh reaksi KrF2 dengan [HC≡NH] +
[AsF] dengan suhu dibawah −50°C. HKrCN dan HKrC≡CH (Kripton hidrida-
sianida dan hydrokryptoacetylene) dilaporkan stabil hingga 40 K.](https://image.slidesharecdn.com/gasmulia-141025082002-conversion-gate02-161114030133/85/Gasmulia-23-320.jpg)
![Argon
• Sifat Atom
1. Struktur kristal : kubus pusat muka
2. Bilangan oksidasi : 0
3. Energi ionisasi : ke-1: 1520,6 kJ/mol ke-2 : 3952.3 kJ/mol ke-3: 3931 kJ/mol
4. jari-jari atom :71pm
5. jari-jari kovalen :97 pm
6. jari-jari van der waals : 188pm
• Sifat Kimia : sifat kimia unsur Argon sangat stabil dialam, sehingga selalu dalam
keadaan gas monoatomik. Bilangan Oksidasi dari unsur Ar adalah 0
• Sifat fisik :
1) Melting point: 83.8 [or -189.3 °C (-308.7 °F)] K
2) Boiling point: 87.3 [or -185.8 °C (-302.4 °F)] K
3) Liquid range: 3.5 K
4) Critical temperature: 150.8 [or -122.2 °C (-188 °F)] K Superconduction
temperature: no data K
5) Thermal conductivity: 0.01772 W m-1 K-1](https://image.slidesharecdn.com/gasmulia-141025082002-conversion-gate02-161114030133/85/Gasmulia-24-320.jpg)

![Xenon
• Sifat kimia Xenon(Xe)
-Tidakberwarna
- Tidak berbau
-Tidakberasa
-Pada keadaan standar gas mulia
tidakdapat terbakar.
• Sifat Fisika Xenon(Xe)
-Simbol : Xe
-Radius atom: 1.24 Ǻ
-Volume atom: 42,9cm3/mol
-Massa atom: 131,29
-Titikdidih: 165.1 K
-Radius kovalensi: 1.31Ǻ
-Struktur Kristal : fcc
-Massa jenis : 5,9 g/cm3
-Elektronegativitas : 2.6
-Konfigurasi electron : [Kr]4d10
5s2p6
-Formasi entalpi : 2,3 kj/mol
-Titiklebur : 161,39K
-Bilanganoksidasi : 0,2,4,6
-Entalpi penguapan: 12,64kj/mol
- Afinitas elektronnya mendekatinol](https://image.slidesharecdn.com/gasmulia-141025082002-conversion-gate02-161114030133/85/Gasmulia-26-320.jpg)








