Recommended
PDF
บทที่ 1 อะตอมและตารางธาตุ
PDF
PDF
มวลอะตอม มวลโมเลกุล มวลไอออน
PDF
PDF
บทที่ 3 สมบัติของธาตุและสารประกอบ
PDF
บทที่ 3 ปริมาณสารสัมพันธ์
PPTX
PDF
เรื่องสารรอบตัว ครูเจริญ มีเหมือน
PDF
ฟิสิกส์ 5 ไฟฟ้าสถิตย์ ตอนที่ 1
PDF
PDF
PDF
PPTX
PDF
แบบทดสอบ บทที่ 1 ปฏิสัมพันธ์ในระบบสุริยะ
PDF
PDF
Microsoft power point ปฏิกิริยาเคมี
PDF
4 กฎรวมแก๊ส กฎแก๊สอุดมคติ
PDF
PDF
6 ทฤษฎีจลน์และการแพร่ของแก๊ส
PDF
PDF
แบบฝึกหัดอัตราการเกิดปฏิกิริยาเคมี
PDF
PDF
PDF
PDF
PDF
PDF
PDF
การคำนวณเกี่ยวกับสูตรเคมี
PDF
วิทยาศาสตร์กายภาพ 1 เรื่อง อากาศ
PDF
ธาตุและสารประกอบ (elements and compound)
More Related Content
PDF
บทที่ 1 อะตอมและตารางธาตุ
PDF
PDF
มวลอะตอม มวลโมเลกุล มวลไอออน
PDF
PDF
บทที่ 3 สมบัติของธาตุและสารประกอบ
PDF
บทที่ 3 ปริมาณสารสัมพันธ์
PPTX
PDF
เรื่องสารรอบตัว ครูเจริญ มีเหมือน
What's hot
PDF
ฟิสิกส์ 5 ไฟฟ้าสถิตย์ ตอนที่ 1
PDF
PDF
PDF
PPTX
PDF
แบบทดสอบ บทที่ 1 ปฏิสัมพันธ์ในระบบสุริยะ
PDF
PDF
Microsoft power point ปฏิกิริยาเคมี
PDF
4 กฎรวมแก๊ส กฎแก๊สอุดมคติ
PDF
PDF
6 ทฤษฎีจลน์และการแพร่ของแก๊ส
PDF
PDF
แบบฝึกหัดอัตราการเกิดปฏิกิริยาเคมี
PDF
PDF
PDF
PDF
PDF
PDF
PDF
การคำนวณเกี่ยวกับสูตรเคมี
Similar to Chap 3 atomic structure
PDF
วิทยาศาสตร์กายภาพ 1 เรื่อง อากาศ
PDF
ธาตุและสารประกอบ (elements and compound)
PDF
บทที่ 2 อะตอมและสมบัติธาตุ.pdf
PDF
PDF
พื้นฐานทฤษฎีอะตอมและโครงแบบอิเล็กตรอน
PDF
โครงสร้างอะตอมและตารางธาตุ
PDF
PPT
PDF
2.สรุปเนื้อหาเคมี เรื่อง โครงสร้างอะตอม
PPT
PPT
PDF
LllĺlllllllllDoc_25651219141929_499350.pdf
PPS
PPT
PDF
โครงสร้างอะตอม.pdfวยกสยบปานสรรรเคารจผงบวแสสารแ
PPTX
โครงสร้างอะตอมและระบบพีริออดิก
PPTX
โครงสร้างอะตอมและตารางธาตุ (โครงงานคอมพิวเตอร์)
DOCX
บทที่ 5 โครงสร้างอะตอมและตารางธาตุ
PDF
Book2013 jan 07_2013_chem
PDF
Book2013 jan 07_2013_chem
More from Gawewat Dechaapinun
PDF
PPTX
Chapter 2.1 glaze classifications
PPTX
บทที่ 2 ประเภทของบทเรียนคอมพิวเตอร์
PPTX
Chapter 1.3 properties of glass crystalline mixtures
PPTX
Chapter 4 properties of glazes and control
PPTX
PDF
PPTX
PDF
Chapter 2.3 glaze calculations
DOCX
บทที่ 8 แนวคิดและความเชื่อเรื่องผีในคัมภีร์พระพุทธศาสนาเถร
DOCX
บทที่ 8 แนวคิดและความเชื่อเรื่องผีในคัมภีร์พระพุทธศาสนาเถร
PDF
Chapter 3 glaze manufacturing
PDF
เน€เธ—เธเนเธเนเธฅเธขเธตเธเธฑเธเนเธฅเธฐเธเธฅเนเธกเน
PPT
เน€เธ—เธเนเธเนเธฅเธขเธตเธเธฑเธเนเธฅเธฐเธเธฅเนเธกเน
PPTX
Chapter 3 glaze manufacturing
PPTX
Chapter 3 glaze manufacturing
PPTX
PPTX
PPTX
PPTX
Chap 3 atomic structure 1. 2. 3-2
ทฤษฎีอะตอมของ Dalton (1808)
John Dalton
1. สสารทุกชนิดประกอบขึ้นจาก อนุภาค
ขนาดเล็ก ที่เรียกว่า อะตอม ซึ่งไม่สามารถ
แบ่งแยกหรือสูญหายไปได้
2. อะตอมของธาตุแต่ละชนิดจะมีมวลและ
สมบัติเหมือนกันทุกประการและแตกต่างจากอะตอมของธาตุอื่น
3. อะตอมของธาตุหนึ่งไม่สามารถเปลี่ยนไปเป็นอะตอมของ
ธาตุชนิดอื่นได้
4. สารประกอบแต่ละชนิดได้จากการรวมตัวกันของอะตอม
ธาตุตั้งแต่สองชนิด ด้วยอัตราส่วนจานวนอะตอมคงที่
3. ทฤษฎีอะตอมของดาลตัน (Dalton)
1. ธาตุ (element) ประกอบด้วยอนุภาคขนาดเล็กมากเรียกว่า
อะตอม อะตอมของธาตุหนึ่ง ๆ จะมีลักษณะเหมือนกัน มี
ขนาดและมวลเท่ากัน และมีสมบัติทางเคมีเหมือนกัน
อะตอมของธาตุหนึ่งจะแตกต่างจากอะตอมของธาตุอื่น ๆ
2. สารประกอบ (compounds) ประกอบด้วยอะตอมของธาตุ
มากกว่าหนึ่งชนิด โดยมีอัตราส่วนของจานวนอะตอมของ
ธาตุคงที่เสมอ
3. ปฏิกิริยาเคมีเกิดจากการจัดเรียงตัวใหม่ของอะตอมโดย
อะตอมไม่ได้ถูกสร้างขึ้นใหม่หรือถูกทาลายลง
3-3
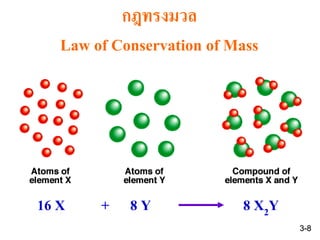
4. 5. 6. กฎสัดส่วนพหุคูณ
Law of Multiple Proportions
อัตราส่วนมวลของ O ใน CO และ CO2 เป็น 1:2 เมื่อให้มวลของ C คงที่
1
1
=
1
2=
ถ้าธาตุสองธาตุสามารถเกิดสารประกอบได้มากกว่าหนึ่งชนิด
อัตราส่วนมวลของธาตุชนิดหนึ่งที่รวมกับธาตุอีกชนิดหนึ่งที่มีมวลคงที่
ในสารประกอบที่ต่างกันนั้นจะเป็นเลขสัดส่วนของจานวนเต็มน้อย ๆ
เช่น
3-6
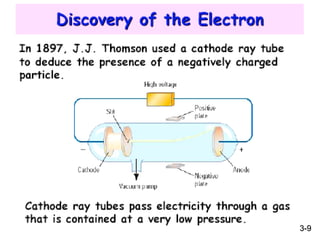
7. 8. 9. 10. รังสีแคโทดจะเบนเข้าหาขั้วแอโนดเสมอ
1. รังสีแคโทดเดินทางเป็นเส้นตรง
2. มีประจุลบ เบี่ยงเบนในสนามไฟฟ้ าและสนามแม่เหล็ก
3. มีค่าประจุต่อมวลคงที่ จากการศึกษาเกี่ยวกับ Oil - drop
experiment ของ แอนดรูว์ มิลลิแกน พบว่า อนุภาคในรังสีแคโทดมีค่า
ประจุต่อมวลคงที่ 1.76 x 108 คูลอมบ์ต่อกรัม ไม่ว่าจะใช้โลหะชนิดใด
เป็นขั้วไฟฟ้ าหรือแก๊สที่ใช้บรรจุในหลอดรังสีแคโทดก็ตาม ดังนั้นจึง
สรุปว่า อนุภาคในรังสีแคโทดเป็นอนุภาคมูลฐานของอะตอมและมี
ประจุลบ ต่อมาเรียกว่า อนุภาคอิเล็กตรอน
รังสีแคโทด มีสมบัติดังนี้
3-10
11. 12. 13. 14. ค.ศ. 1886 โกลด์ สไตน์ ได้ค้นพบโปรตอน
จากการทดลองเกี่ยวกับหลอดรังสีแคโทด พบว่า
มีอนุภาคเคลื่อนที่ตรงข้ามกับรังสีแคโทด
เรียกว่า รังสีแคนนอน หรือ รังสีบวก พร้อมศึกษา
สมบัติของรังสีชนิดนี้ และได้มีการทดลองหา ค่า
ของโปรตอนในเวลาต่อมา โดยบรรจุแก๊ส H2
ในหลอด
3-14
15. 16. • The first experimental evidence of protons came from the study of
canal rays observed in special cathode ray tube with a perforated
anode.
Protons - Subatomic particles with a unit of positive charge (+1).
• Proton Charge: +1.602 x 10-19 C
• Proton Mass: 1.673 x 10-24 g 3-16
17. 18. ประจุของอิเล็กตรอน = -1.60 x 10-19 C
ประจุต่อมวลของอิเล็กตรอน = -1.76 x 108 C/g
มวลของอิเล็กตรอน = 9.10 x 10-28 g
การหาประจุของ
อิเล็กตรอนโดย
Millikan
3-18
19. 20. 21. 22. 23. รัศมีอะตอม (atomic radius) ~ 100 pm = 1 x 10-10 m
รัศมีนิวเคลียส (nuclear radius) ~ 5 x 10-3 pm = 5 x 10-15 m
แบบจาลองอะตอม
ของ Rutherford
1 pm = 1 x 10-12 m
3-23
24. 25. การทดลองของ Chadwick
H อะตอมมี 1 p, He อะตอม มี 2 p
มวลของ He/มวลของ H ควร = 2
มวลของ He/มวลของ H ที่หาได้ = 4
a + 9Be 1n + 12C + energy
นิวตรอน (n) มีประจุเป็นกลาง (0)
มวลของนิวตรอน ~ มวลของโปรตรอน = 1.67 x 10-24 g 3-25
26. 27. เลขอะตอม (Z) = จานวนโปรตอนในนิวเคลียส
เลขมวล (A) = จานวนโปรตอน + จานวนนิวตรอน
= เลขอะตอม (Z) + จานวนนิวตรอน
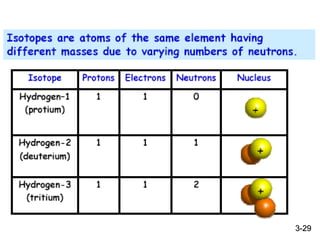
ไอโซโทป คือ อะตอมของธาตชนิดเดียวกัน (X) แต่มีจานวน
นิวตรอนในนิวเคลียสที่แตกต่างกัน
XA
Z
H1
1 H (D)2
1 H (T)3
1
U235
92 U238
92
เลขมวล
เลขอะตอม สัญลักษณ์ของธาตุ
3-27
28. 29. 30. มีโปรตอน นิวตรอน และอิเล็กตรอนเท่าไร ?C14
6
มีโปรตอน นิวตรอน และอิเล็กตรอนเท่าไร ?C11
6
6 โปรตอน, 8 (14 - 6) นิวตรอน, 6 อิเล็กตรอน
6 โปรตรอน, 5 (11 - 6) นิวตรอน, 6 อิเล็กตรอน
การหาจานวน subatomic particles
ในไอโซโทป
3-30
31. 32. 33. 34. ไอออน เป็นอะตอมหรือกลุ่มของอะตอมที่มีประจุเป็นบวกหรือลบ
แคทไอออน (cation) : ไอออนที่มีประจุบวก
ถ้าหากอะตอมที่เป็นกลางสูญเสียอิเล็กตรอน 1 ตัวหรือมากกว่า
จะกลายสภาพเป็นแคทไอออน
Na 11 โปรตอน
11 อิเล็กตรอน
Na+ 11 โปรตอน
10 อิเล็กตรอน
Cl 17 โปรตอน
17 อิเล็กตรอน
Cl- 17 โปรตอน
18 อิเล็กตรอน
แอนไอออน (anion) : ไอออนที่มีประจุลบ
ถ้าหากอะตอมที่เป็นกลางได้รับอิเล็กตรอน 1 ตัวหรือมาก
กว่าจะกลายสภาพเป็นแอนไอออน
3-34
35. monatomic ion คือ ไอออนที่มีเพียงอะตอมเดียว
polyatomic ion คือ ไอออนที่มีหลายอะตอม
Na+, Cl-, Ca2+, O2-, Al3+, N3-
OH-, CN-, NH4
+, NO3
-
3-35
36. 13 โปรตอน, 10 (13 - 3) อิเล็กตรอน
34 โปรตอน, 36 (34 + 2) อิเล็กตรอน
ไอออนและ subatomic particles ?
มีโปรตอนและอิเล็กตรอนจานวนเท่าไร ?Al27
13
3+
Se78
34
2- มีโปรตอนและอิเล็กตรอนจานวนเท่าไร ?
3-36
37. 38. 39. 40. 41. 3-41
สมบัติคลื่น - อนุภาค
JJ Thomson ได้รับรางวัลโนเบล ในการศึกษาอิเล็กตรอนว่าเป็นอนุภาค
George Thomson ผู้เป็นลูก ได้รับรางวัลโนเบลในการศึกษาอิเล็กตรอน
ว่าเป็นคลื่น
42. 43. 43
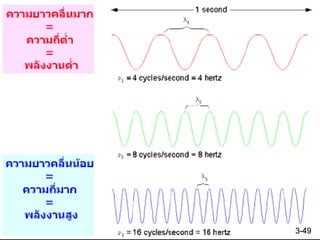
ความถี่ (Frequency; ) เป็นจานวนของคลื่นที่เคลื่อนที่ผ่านจุด ๆ
หนึ่งในเวลา 1 วินาที (Hz = 1 cycle/s)
ความเร็ว (u) ของคลื่น = x 3-43
44. 45. 46. 47. ทฤษฎีควอนตัม (quantum theory) ของ Planck
เมื่อให้ความร้อนแก่ของแข็งสีดา (black body) ของแข็งจะปล่อยรังสี
แม่เหล็กไฟฟ้ าออกมา จากการทดลองพบว่า พลังงานที่แผ่ออกมาใน
แต่ละช่วงอุณหภูมิของชิ้นวัตถุขึ้นอยู่กับความถี่คลื่น ซึ่งขัดกับทฤษฎี
คลาสสิกที่ว่าพลังงานขึ้นกับความเข้มของแสงเพียงอย่างเดียว
Planck กล่าว ว่าพลังงานแสงจะถูกปล่อย (emit) หรือดูดกลืน
(absorb) ในหน่วย ควอนตัม (quantum) ซึ่งหมายถึงหน่วยที่เล็กที่สุด
ของปริมาณพลังงานคลื่นแม่เหล็กไฟฟ้ าที่ถูกปล่อยหรือดูดกลืน
E = h x
Planck’s constant (h)
H = 6.63 x 10-34 J.s 3-47
48. พลังงาน (E) ของรังสีแม่เหล็กไฟฟ้ าขึ้นอยู่กับความถี่ ()
E = h
E = พลังงาน Joules (kg.m2/s2)
h = ค่าคงที่ของ Planck (6.626 x 10-34 J.s)
= ความถี่ (hz, sec-1)
3-48
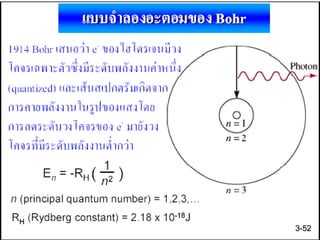
49. 50. 51. 52. 53. 54. 55. 56. 57. E = h V
E = h V = hc
E = พลังงาน หน่วย จูล
h = ค่าคงที่ของแพลงค์ = 6.625 x 10-34 จูล - วินาที
v = ความถี่ของคลื่นแม่เหล็กไฟฟ้า หน่วย เฮิรต์
c = ความเร็วของคลื่นแม่เหล็กไฟฟ้าในสุญญากาศ
= 3 x 108 เมตรต่อวินาที
สภาวะเร้า
สภาวะพื้น
3-57
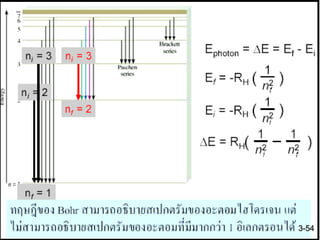
58. 59. 60. 61. 62. รูปทรงต่าง ๆ ของกลุ่มหมอกอิเล็กตรอน จะขึ้นอยู่กับระดับพลังงานของ
อิเล็กตรอน การใช้ทฤษฎีควอนตัม จะสามารถอธิบายการจัดเรียงตัวของ
อิเล็กตรอนรอบนิวเคลียส ได้ว่าอิเล็กตรอนจัดเรียงตัวเป็นออร์บิทัล
(orbital) ในระดับพลังงานย่อย s, p, d, f แต่ละออร์บิทัล จะบรรจุ
อิเล็กตรอนเป็นคู่ ดังนี้
แต่ละออร์บิทัลจะมีรูปร่างลักษณะแตกต่างกัน ขึ้นอยู่กับการเคลื่อนที่ของ
อิเล็กตรอนในออร์บิทัล และระดับพลังงานของอิเล็กตรอนในออร์บิทัล
นั้น ๆ เช่น
s - orbital มี 1 ออร์บิทัล หรือ 2 อิเล็กตรอน
p - orbital มี 3 ออร์บิทัล หรือ 6 อิเล็กตรอน
d - orbital มี 5 ออร์บิทัล หรือ 10 อิเล็กตรอน
f - orbital มี 7 ออร์บิทัล หรือ 14 อิเล็กตรอน
3-62
63. s - orbital มีลักษณะเป็นทรงกลม
p - orbital มีลักษณะเป็นกรวยคล้ายดัมเบล ลักษณะแตกต่าง
กัน 3 แบบตามจานวนอิเล็กตรอนใน 3 ออร์บิทัล คือ Px,
Py, Pz
d - orbital มีลักษณะและรูปทรงของกลุ่มหมอก แตกต่างกัน
5 แบบตามจานวนอิเล็กตรอนใน 5 ออร์บิทัล คือ dx –y , dz ,
dxy , dyz , dxz
2 2 2
3-63
64. Px Py Pz
s - orbital
p - orbital
dx
2
-y
2 dxy dxz dyz dz
2
d - orbital
3-64
65. การจัดอิเล็กตรอนในระดับพลังงานย่อย
(subshell / energy sublevel)
3-65
จากการศึกษาสเปกตรัมและกลศาสตร์ควอนตัมของคลื่น
ทาให้ทราบว่า ระดับพลังงานของอิเล็กตรอน ในระดับพลังงาน
เดียวกัน ยังแบ่งเป็นระดับพลังงานย่อยต่าง ๆ ซึ่งมี 4 ระดับ
พลังงานย่อย ได้แก่ s, p, d , f subshell แต่ละระดับพลังงานย่อย
จะมีจานวนอิเล็กตรอนต่าง ๆ กันดังนี้
66. 67. 68. 69. 70. เลขควอนตัม (Quantum Number)
1. Principal Quantum Number (n)
n = 1, 2, 3, ... .
ถ้า n มีค่ามากขึ้น e- จะอยู่ห่างจากนิวเคลียสมากขึ้น
พลังงานมากขึ้น เสถียรน้อยลง และออร์บิทัลมีขนาดใหญ่ขึ้น
3-70
71. 2. Orbital Quantum Number หรือ
Angular Momentum Quantum Number (l)
l บอกรูปร่างของออร์บิทัล
l = 0, 1, 2 , … , n-1 (มี n ค่า)
จะบอกว่า l มีค่าเท่าใดต้องทราบ n ก่อน เช่น
n = 1 , l มีค่าได้ 1 ค่า คือ 0 s - orbital
n = 2 , l มีค่าได้ 2 ค่า คือ 0,1 p - orbital
n = 3 , l มีค่าได้ 3 ค่า คือ 0, 1, 2 d - orbital
3-71
72. 3. Magnetic Quantum Number (m)
อธิบายการจัดเรียงตัวของออร์บิทัล
จานวนค่าของ m แสดงจานวนออร์บิทัลสาหรับ l แต่ละค่า
l = 0 , m = 0 (s มี 1 ออร์บิทัล)
ค่า m ขึ้นกับ l
m = มีได้ (2l + 1) และค่าเริ่มจาก (-1) (ผ่าน0) ถึง (+1)
l = 1 , m = -1, 0, 1 (p มี 3 ออร์บิทัล)
l = 2 , m = -2, -1, 0, 1, 2 (d มี 5 ออร์บิทัล)
3-72
73. 4. Electron Spin Quantum Number (s)
e- จะหมุน (spin) รอบ
แกนที่ผ่านจุดศูนย์กลาง
ทาให้เกิดสนามแม่เหล็ก
s ไม่มีผลต่อพลังงาน ขนาด รูปร่าง หรือ การจัดเรียง
ตัวของออร์บิทัล แต่แสดงการจัดเรียง e- ในออร์บิทัล
e-
s = -1/2
N
S
s = +1/2
e-
S
N
e-
Counter - clockwise
spin (high energy)
Clockwise spin
(low energy)
3-73
74. ความสัมพันธ์ระหว่าง quantum numbers และ atomic orbitals
2 3d -2,-1,0,1,2 5 3dxy , 3dyz , 3dxz
3d x
2
- y
2 , 3dz
2
n l subshell m no. of orbitals atomic orbitals
1 0 1s 0 1 1s
2 0 2s 0 1 2s
1 2p -1,0,1 3 2px, 2py, 2pz
3 0 3s 0 1 3s
1 3p -1,0,1 3 3px, 3py, 3pz
3-74
75. ความสัมพันธ์ระหว่าง quantum numbers และ atomic orbitals
n l subshell m no. of orbitals atomic orbitals
3 4f -3, -2, -1, 0, 1, 2, 3 7
4 0 4s 0 1 4s
1 4p -1, 0, 1 3 4px, 4py, 4pz
2 4d -2,-1, 0, 1, 2 5 4dxy , 4dyz , 4dxz,
4dx
2
-y
2 , 4dz
2
3-75
76. 77. 78. หลักกีดกันเพาลี
(Pauli Exclusion Principle)
ถ้า 2 e- ในอะตอม มีค่า n, l, mเหมือนกัน (อยู่ใน
atomic orbital เดียวกัน) จะต้องมีค่า s ต่างกัน
ไม่มี e- คู่ใดในอะตอม มีเลขควอนตัมทั้งสี่เท่ากัน
แต่ละออร์บิทัล จะบรรจุ e- ได้มากที่สุด 2 e- ซึ่งมี
สปินตรงกันข้าม (s ต่างกัน)
3-78
79. 80. 81. 4Be
1s 2s 2p
ใน principal quantum number เดียวกัน
ระดับพลังงาน s < p < d < f < …
2px, 2py, 2pz มีพลังงานเท่ากัน
ออร์บิทัลที่มีพลังงานเท่ากัน เรียกว่า
“degenerate orbitals”
diamagnetic
paramagnetic5B
1s 2s 2p
3-81
82. หรือ C
1s2 2s2 2p2
หลักเกณฑ์ฮุนด์ (Hund ’s Rule)
การจัดเรียง e- ในออร์บิทัลที่เสถียรที่สุด คือ การจัดเรียง
แบบที่มีจานวนสปินในทิศทางเดียวกันมากที่สุด
6C
Electron Configuration 1s2 2s2 2p2
paramagnetic
3-82
83. Element Total e- orbital diagram Electron Configuration
H 1 1s1
He 2 1s2
Li 3 1s22s1 = [He] 2s1
Be 4 1s22s2 = [He] 2s2
B 5 1s22s22p1 = [He] 2s22p1
C 6 1s22s22p2 = [He] 2s22p2
N 7 1s22s22p3 = [He] 2s22p3
O 8 1s22s22p4 = [He] 2s22p4
F 9 1s22s22p5 = [He] 2s22p5
Ne 10 1s22s22p6 = [He] 2s22p6
Na 11 1s22s22p63s1 = [Ne] 3s1
1s 2s 2p 3s 3-83
84. 85. เลขอะตอม ธาตุ เรียงตามกฎของฮุนด์ เรียงให้สอดคล้องกับสมบัติแม่เหล็ก
24
29
42
46
47
57
78
79
89
Cr
Cu
Mo
Pd
Ag
La
Pt
Au
Ac
18[Ar] 3d4 4s2
18[Ar] 3d9 4s2
36[Kr] 4d4 4s2
36[Kr] 4d8 4s2
36[Kr] 4d9 4s2
53[Xe] 4f1 6s2
53[Xe] 4f14 5d8 6s2
53[Xe] 4f14 5d9 6s2
86[Rn] 5f1 7s2
18[Ar] 3d5 4s1
18[Ar] 3d10 4s1
36[Kr] 4d5 4s1
36[Kr] 4d10
36[Kr] 4d10 5s1
53[Xe] 5d1 6s2
53[Xe] 4f14 5d9 6s1
53[Xe] 4f14 5d10 6s1
86[Rn] 6d1 7s2
หมายเหตุ : 4f และ 5d, 5f และ 6d มีพลังงานใกล้เคียงกันมาก, การจัด
แบบ filled และ half - filled ถือว่าเสถียรที่สุด 3-85
86. หลักเอาฟ์ บาว (Aufbau Principle)
การบรรจุ e- ในออร์บิทัลต่าง ๆ เป็นไปตามลาดับดังนี้
1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5p 5f
6s 6p 6d 6f
7s 7p 7d 7f
3-86
87. 88. 25Mn
Stability
Full - filled > half - filled > other configuration
[Ar] 4s2 3d5
26Fe [Ar] 4s2 3d6
27Co [Ar] 4s2 3d7
28Ni [Ar] 4s2 3d8
29Cu [Ar] 4s1 3d10
Full - filled configuration30Zn [Ar] 4s2 3d10
3-88
89. 90. 2) 26Fe : 1s2 2s2 2p6 3s2 3p6 3d6 4s2
24Fe2+ : 1s2 2s2 2p6 3s2 3p6 3d6
23Fe3+ : 1s2 2s2 2p6 3s2 3p6 3d5
3) 17Cl : 1s2 2s2 2p6 3s2 3p5
18Cl- : 1s2 2s2 2p6 3s2 3p6
อิเล็กตรอนที่แอนไอออนรับไว้จะอยู่ในระดับ
พลังงานค่า n สูงสุดเสมอ
3-90
91. การบ้าน
1. การจัดอิเล็กตรอนแบบต่าง ๆ ต่อไปนี้ ข้อใดผิด พร้อมให้
เหตุผลประกอบ
ก. 1s2 2s1
ข. 1s1
ค. 1s2 3s
ง. 1s2 2s2 2p8 3s
2. ถ้ามีอิเล็กตรอน 1 ตัว อยู่ใน 2p - orbital จงบอกค่าเลข
ควอนตัมที่เป็นไปได้สาหรับอิเล็กตรอนนี้
3-91
92. 4. เขียนการจัดเรียงอิเล็กตรอน สาหรับธาตุต่อไปนี้
ก. Ca เลขอะตอม 20 ข. Ti เลขอะตอม 22
ค. Si เลขอะตอม 14 ง. Br เลขอะตอม 35
5. เขียนแผนผังออร์บิทัล (orbital diagram) สาหรับธาตุ
ต่อไปนี้
ก. Ca เลขอะตอม 20 ข. Ti เลขอะตอม 22
ค. Si เลขอะตอม 14 ง. Br เลขอะตอม 35 3-92
3. อิเล็กตรอน 1 ตัว มีเลขควอนตัม (n, l, ml , ms) เป็น 3, 0, 0,
+1/2 อิเล็กตรอนนี้อยู่ใน shell ใด และ subshell ใด








































































![Element Total e- orbital diagram Electron Configuration
H 1 1s1
He 2 1s2
Li 3 1s22s1 = [He] 2s1
Be 4 1s22s2 = [He] 2s2
B 5 1s22s22p1 = [He] 2s22p1
C 6 1s22s22p2 = [He] 2s22p2
N 7 1s22s22p3 = [He] 2s22p3
O 8 1s22s22p4 = [He] 2s22p4
F 9 1s22s22p5 = [He] 2s22p5
Ne 10 1s22s22p6 = [He] 2s22p6
Na 11 1s22s22p63s1 = [Ne] 3s1
1s 2s 2p 3s 3-83](https://image.slidesharecdn.com/chap3atomicstructure-160229074504/85/Chap-3-atomic-structure-83-320.jpg)

![เลขอะตอม ธาตุ เรียงตามกฎของฮุนด์ เรียงให้สอดคล้องกับสมบัติแม่เหล็ก
24
29
42
46
47
57
78
79
89
Cr
Cu
Mo
Pd
Ag
La
Pt
Au
Ac
18[Ar] 3d4 4s2
18[Ar] 3d9 4s2
36[Kr] 4d4 4s2
36[Kr] 4d8 4s2
36[Kr] 4d9 4s2
53[Xe] 4f1 6s2
53[Xe] 4f14 5d8 6s2
53[Xe] 4f14 5d9 6s2
86[Rn] 5f1 7s2
18[Ar] 3d5 4s1
18[Ar] 3d10 4s1
36[Kr] 4d5 4s1
36[Kr] 4d10
36[Kr] 4d10 5s1
53[Xe] 5d1 6s2
53[Xe] 4f14 5d9 6s1
53[Xe] 4f14 5d10 6s1
86[Rn] 6d1 7s2
หมายเหตุ : 4f และ 5d, 5f และ 6d มีพลังงานใกล้เคียงกันมาก, การจัด
แบบ filled และ half - filled ถือว่าเสถียรที่สุด 3-85](https://image.slidesharecdn.com/chap3atomicstructure-160229074504/85/Chap-3-atomic-structure-85-320.jpg)

![[Ar
]
18Ar
19K
21Sc
[Ar]
[Ar] [Ar] 4s1 3d5
Half - filled
configuration
1s2 2s2 2p6 3s2 3p6
[Ar] 4s1
[Ar] 4s2
20Mg
[Ar] 4s2 3d1
22Ti [Ar] 4s2 3d2
23V [Ar] 4s2 3d3
24Cr
[Ar]
3-87](https://image.slidesharecdn.com/chap3atomicstructure-160229074504/85/Chap-3-atomic-structure-87-320.jpg)
![25Mn
Stability
Full - filled > half - filled > other configuration
[Ar] 4s2 3d5
26Fe [Ar] 4s2 3d6
27Co [Ar] 4s2 3d7
28Ni [Ar] 4s2 3d8
29Cu [Ar] 4s1 3d10
Full - filled configuration30Zn [Ar] 4s2 3d10
3-88](https://image.slidesharecdn.com/chap3atomicstructure-160229074504/85/Chap-3-atomic-structure-88-320.jpg)



