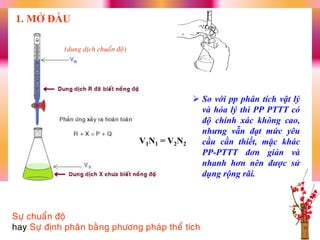
Tài liệu trình bày phương pháp phân tích thể tích, bao gồm nguyên tắc, khái niệm về điểm tương đương và điểm kết thúc trong chuẩn độ. Nó cũng phân loại các phương pháp phân tích và cách xác định nồng độ dung dịch chuẩn, cùng với các chỉ thị phù hợp để xác định điểm kết thúc. Ngoài ra, tài liệu nêu rõ yêu cầu về độ tinh khiết và tính ổn định của chất chuẩn hoá học.