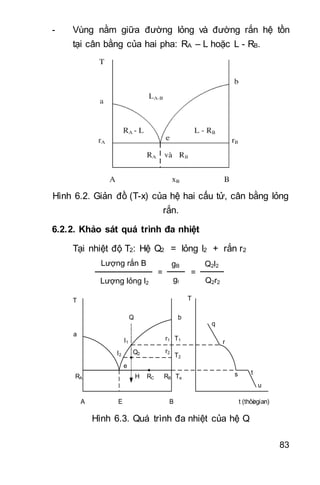
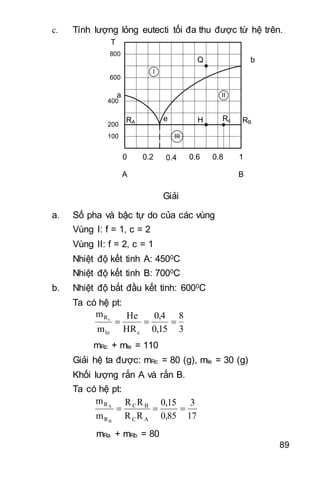
Tài liệu trình bày các nguyên lý cơ bản của nhiệt động học, bao gồm nguyên lý I và II, cân bằng hóa học, điện hóa học và động hóa học. Nó cũng hướng dẫn cách áp dụng các định luật liên quan đến nhiệt và công trong các quá trình hóa học và vật lý. Bên cạnh đó, tài liệu cung cấp ví dụ cụ thể để minh họa các khái niệm lý thuyết.






















![23
Phản ứng: 3Fe(r) + 4H2O(h) = Fe3O4(r) + 4H2(k)
a. Tính H0
298 = -267 - 4.(-57,8) = - 35,8 Kcal.
Tính U0
298 = H0
298 - nR.T với n = 4 - 4 = 0
Do đó U0
298 = H0
298 = -35,8 Kcal
b. Tính H0
1000 = H0
298 +
1000
298
ΔCp.dT
Cp = [4.Cp(H2) + Cp(Fe3O4)] – [4.Cp(H2O) + 3.Cp(Fe)]
Cp = 44,53 - 5,08.10-3.T
Ta có:
H0
1000 = -35800 +
1000
298
3
.T)dT5,08.10(44,53
= - 6854,37 (cal)
U0
1000 = H0
1000 - nRT với n = 4 - 4 = 0
U0
1000 = H0
1000 = - 6854,37 (cal)
c. Xét chiều phản ứng ở đktc từ công thức:
G0
298 = H0
298 – T.S0
298.
Trong đó:
S0
298 = (4x32,21 + 35) – (4x45,1 + 3x6,49)
= - 36,03 (cal)
G0
298 = -35800 + 298x36,03 = - 25063,06 (cal)
Vì: G0
298 < 0 nên phản ứng tự diễn biến.
2.4. Bài tập tự giải
1. Tính biến thiên entropy của quá trình đun nóng
đẳng áp 1 mol KBr từ 298 đến 500K, biết rằng
trong khoảng nhiệt độ đó: Cp(KBr) = 11,56 +
3,32.10-3T cal/mol.
ĐS: 6,65 cal/mol.K](https://image.slidesharecdn.com/hoalylythuytbaitpligii-200604142941/85/Hoa-ly-23-320.jpg)












































































![106
Ví dụ 12. Tính thế điện cực: Zn/ ZnCl2 (0,005N) ở 250C
cho biết độ dẫn điện đương lượng của dung dịch là 89
-1.đlg-1.cm2, độ dẫn điện đương lượng giới hạn của
dung dịch là 113,7 -1.dlg-1cm2 và điện thế tiêu chuẩn
của điện cực Zn là -0,76V.
Giải
Độ phân ly của dung dịch ZnCl2 là:
89
113,7
Nồng độ của Zn2+:
[Zn2+] = 0,783 0,005 = 0,004 N = 0,002 M
Thế điện cực:
20,059
lg[Zn ]
2
V0,839lg0,002
2
0.059
0,76
Ví dụ 13. Cho pin Cd / Cd2+ // CuSO4 / Cu có sức điện
động là 0,745V. Hãy xác định độ phân ly của dung dịch
CuSO4 0,1N cho biết điện thế tiêu chuẩn của điện cực
Cu là 0,34V, của điện cực Cd là -0,4V và nồng độ ion
Cd2+ trong dung dịch là 0,05N.
Giải
Phản ứng xảy ra trong pin:
Cd + Cu2+ = Cd2+ + Cu
Sức điện động của pin như sau:
2
2
0
Cu
Cd
lg
2
0,059
EE](https://image.slidesharecdn.com/hoalylythuytbaitpligii-200604142941/85/Hoa-ly-106-320.jpg)
![107
Trong đó: 0,740,40,34E 000
(V)
Thế vào công thức trên ta được:
2
0,059 [Cu ]
lg
2 0,05
2
[Cu ]
= 0,074 (N)
Độ phân ly:
0,74
0,1
0,074
CuSO
Cu
α
4
2
Ví dụ 14. Cho pin
(Pt) Hg/ Hg2Cl2/ KCl 0,01N// H+ / Quinhydron.
Có sức điện động ở 250C là 0,0096V. Tính pH của dung
dịch biết điện thế điện cực Calomen là 0,3338V và thế
điện cực tiêu chuẩn của điện cực Quinhydron là 0,699V.
Giải
Áp dụng công thức tính pH của dung dịch:
o
Quin Cal E
pH
0,059
0,699 0,3338 0,0096
pH 6,027
0,059
Ví dụ 15. Cho pin, Cu/ CuCl2 (0,7M)// AgNO3 (1M)/ Ag.
Cho biết độ phân ly của dung dịch CuCl2 là 80% và
dung dịch AgNO3 là 85%, điện thế tiêu chuẩn của điện
cực Cu là 0,34V và điện cực Ag là 0,8V. Tính sức điện
động của pin và tính lượng AgNO3 cần thêm vào để sức
điện động của pin tăng thêm 0,02V, cho thể tính bình là
1lít.
Giải
CuCl2 = Cu2+ + 2Cl-](https://image.slidesharecdn.com/hoalylythuytbaitpligii-200604142941/85/Hoa-ly-107-320.jpg)
![108
Nồng độ ion Cu2+: 0,56
100
80
0,7Cu2
(M)
AgNO3 = Ag+ + NO3
-
Nồng độ ion Ag+: 0,85
100
85
1Ag
(M)
Suất điện động của pin:
E0 = 0
+ - 0
- = 0,8 - 0,34 = 0,46 (V)
2
2
0
Ag
Cu
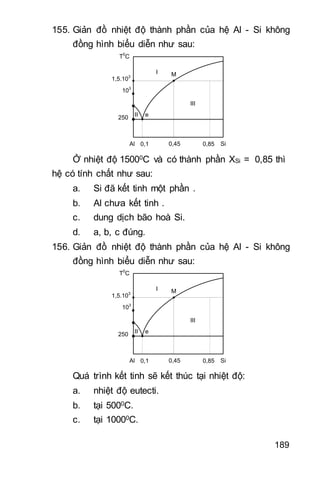
lg
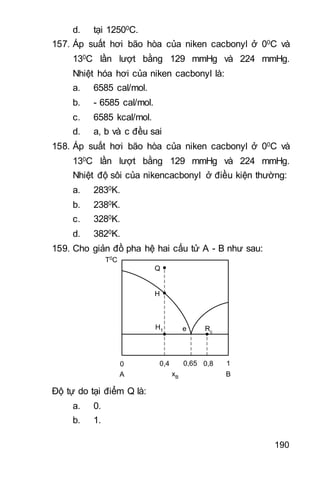
2
0,059
EE
0,463
0,85
0,56
lg
2
0,059
0,46E 2
(V)
Thêm vào suất điện động của pin 0,02V
E = 0,483 (V)
0,483 = 0,46 - 2
0,059 0,56
lg
2 Ag
[Ag+] = 1,836 (M)
[AgNO3] =
1,836
2,16(M)
0,85
3AgNO
n = CM.V = 2,16 x 1 = 2,16 (mol)
Vậy số mol AgNO3 thêm vào là: 2,16 – 1 = 1,16 (mol)
3AgNO
m = 1,16 x 170 = 197,2 (g)
Ví dụ 16. Viết cấu trúc pin trong đó cực âm là điện cực
Hiđro, cực dương là điện cực Calomen. Cho biết điện
cực Calomen nhúng vào dung dịch KCl 0,1M và pH của
dung dịch là 1,0. Tính sức điện động của pin.
Giải
Pt, H2 /H+ //KCl 0,1M /Hg2Cl2/Hg, Pt
Áp dụng công thức:](https://image.slidesharecdn.com/hoalylythuytbaitpligii-200604142941/85/Hoa-ly-108-320.jpg)





![114
a. Nồng độ của NH4OH là 0,1N?
b. Trong 1 lít dung dịch chứa 0,1 mol NH4OH và 0,1
mol NH4Cl. Coi NH4Cl phân ly hoàn toàn.
Giải
Ta có phương trình phân ly:
NH4OH NH4
+ + OH-
a. Trong dung dịch NH4OH 0,1N
2
4
4 4
[NH ].[OH ] [OH ]
K
[NH OH] [NH OH]
Ta tính được:
5 3
4[OH ] K.[NH OH] 2.10 .0.1 1,4.10 M
b. Trong 1 lít dung dịch chứa 0,1 mol NH4OH và 0,1
mol NH4Cl.
4
4
[NH ].[OH ]
K
[NH OH]
Trong đó: 4[NH ]
= [OH ]
+ 0,1 [OH ]
= 2.10-5M
Ví dụ 25. Cho lượng Ag dư vào dung dịch Mo(CN)6
3- 0,1
M, ở 250C có phản ứng xảy ra như sau:
Ag + Mo(CN)6
3- = Ag+ + Mo(CN)6
4-
a. Thành lập pin mà trong đó ở điện cực xảy ra phản
ứng trên.
b. Tính hằng số cân bằng của phản ứng đó
c. Tính nồng độ của Ag+ lúc cân bằng
d. Tính sức điện động của pin ở 250C khi nồng độ của
Mo(CN)6
3- và của Mo(CN)6
4- bằng nhau, nồng độ
Ag+ bằng nồng độ lúc cân bằng (câu c).](https://image.slidesharecdn.com/hoalylythuytbaitpligii-200604142941/85/Hoa-ly-114-320.jpg)





![120
- tn xn vào phương trình động học thu được kn
Nếu k 1, k 2, …k n tương đương nhau thì bậc phản ứng
là bậc đã giả định.
8.1.3.2. Phương pháp dựa trên đặc điểm của chu kỳ
bán hủy
Người ta quan sát đặc điểm của T1/2 và nồng độ và
xem sự tương quan của nó là gì.
8.1.3.3. Phương pháp xác định theo vận tốc đầu
n1A + n2B + n3C +...+ nn Z → Sản phẩm
Vận tốc phản ứng: nn2n1n
Z...BAk.V
Tìm n1: Cho [B], [C], [D]…., [Z] dư
1n
Ak.V
Tìm n2: Cho [A], [C], [D]…., [Z] dư
2n
Bk.V
Tương tự ta có n3, n4,…, nn
N = n1 + n2 +……..+ nn
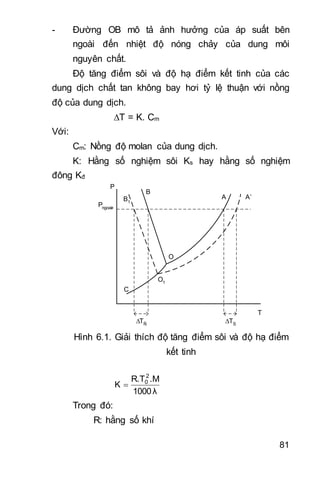
8.1.4. Ảnh hưởng của nhiệt độ đến tốc độ phản ứng
Van’t Hoff khi nghiên cứu sự ảnh hưởng nhiệt độ
đến vận tốc phản ứng thì Ông cho rằng cứ tăng nhiệt độ
lên 100C thì vận tốc phản ứng tăng từ 2 đến 4 lần.
nγ
k
k
T
n.10T
Trong đó: là hệ số nhiệt độ.
8.1.5. Năng lượng hoạt hóa](https://image.slidesharecdn.com/hoalylythuytbaitpligii-200604142941/85/Hoa-ly-120-320.jpg)














































![167
77. Các hằng số cân bằng: Kp = Kc = Kn = Kx khi phản
ứng có:
a. n = 1.
b. n = 0.
c. Δn ≠ 0.
d. Δn ≠ 1.
78. Cho phản ứng: Fe2O3(r) + 3CO(k) = 2 Fe(r) +
3CO2(k), vậy hằng số cân bằng Kp có dạng:
a. 3
co
3
co
p
2
P
P
K .
b. 3
co
3
co
p
P
P
K 2
.
c. 3
co
3
cop .PPK 2
.
d. cocop .3P3PK 2
.
79. Xét phản ứng: CaCO3(r) = CaO(r) + CO2(k). Vậy
Kp của phản ứng trên là:
a. 2cop PK .
b.
2co
p
P
1
K .
c.
][CaO].[COK 2p
.
d.
3
co
p
CaCO.CaO
P
K 2
.
80. Khi phản ứng đạt cân bằng thì:
a. 0ΔG .
b. 0ΔG .
c. 0ΔG
d. 0ΔG .
81. Khi phản ứng có Δn = 0 thì:
a. cxnp KKKK ](https://image.slidesharecdn.com/hoalylythuytbaitpligii-200604142941/85/Hoa-ly-167-320.jpg)




![172
3Fe(r) + 4H2O(h) = Fe3O4(r) + 4H2(k)
Hằng số cân bằng Kp của phản ứng là:
a.
cb
OHFe
HOFe
p
2
243
.PP
.PP
K
b.
cb
O2H
243
4
Fe
H
4
OFe
p
.PP
.PP
K
c.
cbOH
H
p
2
2
P
P
K
d.
cb
OH
4
H
4
p
2
2
P
P
K
97. Cho phản ứng thuận nghịch sau:
N2(k) + 3H2(k) 2NH3(k)
Hằng số cân bằng Kp của phản ứng là:
a.
cbHN
NH
p
22
3
.PP
P
K
b.
cb
3
22
NH
HN
p
P
.PP
K
c.
cb
H
3
N
NH
2
p
22
3
.PP
P
K
d.
cb
NH
2
H
3
N
p
3
22
P
.PP
K
98. Ở một nhiệt độ, phản ứng thuận nghịch dưới đây
có hằng số cân bằng Kc = 4.
A + B C + D
Tại một thời điểm nào đó, ta có nồng độ mol của
từng chất như sau: [A] = 0,2 M; [B] = 0,2M; [C] =](https://image.slidesharecdn.com/hoalylythuytbaitpligii-200604142941/85/Hoa-ly-172-320.jpg)
![173
0,2M; [D] = 0,4M. Phát biểu nào dưới đây là đúng
ứng với thời điểm này:
a. phản ứng đang ở trạng thái cân bằng.
b. phản ứng đang diễn theo chiều thuận.
c. phản ứng đang diễn theo chiều nghịch.
d. không thể biết được.
99. Ở một nhiệt độ, phản ứng thuận nghịch dưới đây
có hằng số cân bằng Kc = 4.
A + B C + D
Tại một thời điểm nào đó, ta có nồng độ mol của
từng chất như sau: [A] = 0,1 M; [B] = 0,2M; [C] = 0,2M;
[D] = 0,4M. Phát biểu nào dưới đây là đúng ứng với thời
điểm này:
a. phản ứng đang ở trạng thái cân bằng.
b. phản ứng đang diễn theo chiều thuận.
c. phản ứng đang diễn theo chiều nghịch.
d. không thể biết được.
100. Ở một nhiệt độ, phản ứng thuận nghịch dưới đây
có hằng số cân bằng Kc = 8.
A + B C + D
Tại một thời điểm nào đó, ta có nồng độ mol của
từng chất như sau: [A] = 0,1 M; [B] = 0,1M; [C] = 0,3M;
[D] = 0,3M. Phát biểu nào dưới đây là đúng ứng với thời
điểm này:
a. phản ứng đang ở trạng thái cân bằng.
b. phản ứng đang diễn theo chiều thuận.
c. phản ứng đang diễn theo chiều nghịch.
d. không thể biết được.](https://image.slidesharecdn.com/hoalylythuytbaitpligii-200604142941/85/Hoa-ly-173-320.jpg)
























![202
d. ion đối.
205. Thực hiện phản ứng trao đổi để điều chế keo AgI
khi cho dư AgNO3:
AgNO3 + KI = AgI + KNO3. Ký hiệu keo sẽ là:
a. [ mAgI nNO3
- (n-x)Ag+ ].xAg+.
b. [ mAgI nAg+ (n-x)NO3
- ].xNO3
-.
c. [ mAgI nAg+ (n+x)NO3
- ].xNO3
-.
d. [ mAgI nNO3
- (n+x)Ag+ ].xAg+.
206. Keo hydronol sắt (III) được điều chế bằng cách cho
từ từ FeCl3 vào nước sôi. Ký hiệu của keo là:
a. [ mFe(OH)3. nFe3+( 3n – x) Cl-].xCl-
b. [ mFe(OH)3. Fe3+( 3n – x) Cl-].xCl-
c. [ mFe(OH)3. nFe3+( 3n + x) Cl-].xCl-
d. [ mFe(OH)3. nFe3+( n - x) Cl-].xCl-
207. Keo hydronol sắt (III) được điều chế bằng cách cho
từ từ FeCl3 vào nước sôi. Ion tạo thế là:
a. Cl-
b. Fe3+
c. OH-
d. H+
208. Keo hydronol sắt (III) được điều chế bằng cách cho
từ từ FeCl3 vào nước sôi. Hạt keo mang điện tích
là:
a. âm
b. dương
c. không mang điện tích
d. không thể xác định](https://image.slidesharecdn.com/hoalylythuytbaitpligii-200604142941/85/Hoa-ly-202-320.jpg)















![218
b. Sb2O3 + H2O + 6e = 2Sb + 6OH-
c. Sb2O3 + 3H2O + 6e = Sb + 6OH-
d. Sb2O3 + 3H2O + 6e = 2Sb + OH-
266. Cho phản ứng xảy ra trong pin như sau:
H2 + Cl2 = 2HCl
Pin được hình thành từ các điện cực là:
a. Pt, H2/ HCl/ Cl2, Pt
b. Pt, Cl2/ HCl/ Cl2, Pt
c. Pt, H2/ HCl/ H2, Pt
d. Pt, Cl2/ HCl/ H2, Pt
267. Phản ứng H2 + I2 = 2HI là phản ứng một chiều
đơn giản. Biểu thức tốc độ phản ứng là:
a. v = k.[H2].[I2]
b. v = k.[H2].[I2]2
c. v = k.[HI]2
d. v = k.[H2]2.[I2]
268. Phản ứng bậc một: A sản phẩm. Biểu thức
phương trình động học của phản ứng bậc một là:
a. kt
C
C
ln 0
A
A
b. kt
C
C
ln
A
0
A
c. t
C
C
ln
k
1
A
0
A
d. b và c đều đúng
269. Phản ứng bậc một: A sản phẩm. Biểu thức
chu kỳ bán hủy là:
a.
ln2
k
t1/2 ](https://image.slidesharecdn.com/hoalylythuytbaitpligii-200604142941/85/Hoa-ly-218-320.jpg)






