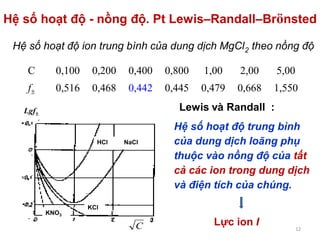
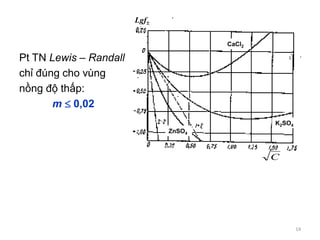
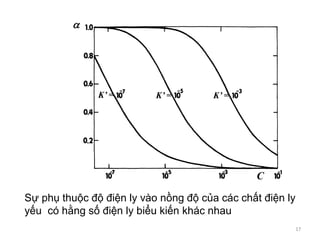
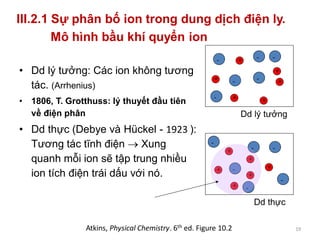
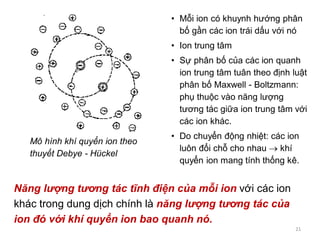
Tài liệu trình bày về tương tác ion-ion trong dung dịch điện ly, nhấn mạnh vai trò của hoạt độ và hệ số hoạt độ trong việc mô tả các tính chất của dung dịch này. Đồng thời, nó cũng đề cập đến thuyết tĩnh điện Debye-Hückel và sự phân bố ion trong dung dịch, từ đó phân tích phương pháp xác định hệ số hoạt độ của ion trong các dung dịch không lý tưởng. Cuối cùng, tài liệu còn mô tả sự phụ thuộc của định luật tĩnh điện vào nồng độ và bản chất của các ion trong dung dịch.



![Toàn bộ tương tác
trong dung dịch điện ly
Sử dụng hoạt độ
thay cho nồng độ.
Biểu thức nhiệt động viết cho dung dịch lý
tưởng nhưng đã thay nồng độ bằng hoạt độ
thì sẽ phù hợp với kết quả thực nghiệm.
][
]][[
HA
AH
K
HA
AH
a
aa
K
mô tả một cách
hình thức
4](https://image.slidesharecdn.com/baigiangchuong3-150103215336-conversion-gate02/85/Bai-giang-chuong-3-4-320.jpg)










![23
kT
eZ
eZn oi
oiio
exp.
....
!2
1
2
x
xex
xex
1
x << 1
1
kT
eZ oi
năng lượng tương tác tĩnh điện rất nhỏ so
với năng lượng chuyển động nhiệt.
)()(]1.[
22
kT
eZn
eZn
kT
eZ
eZn oiio
oiio
oi
oiio
(nioZieo) = 0
Dung dịch trung hòa về điện
)( 2
2
ioi
o
Zn
kT
e](https://image.slidesharecdn.com/baigiangchuong3-150103215336-conversion-gate02/85/Bai-giang-chuong-3-23-320.jpg)

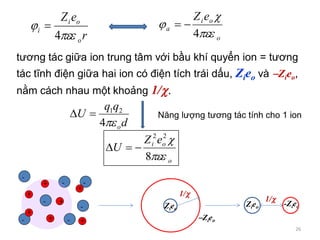
![25
r
eeZ r
o
oi
4
a = [ - i]r 0
thế gây bởi bầu khí quyển ion
tại vị trí của ion trung tâm
thế của bầu khí
quyển ion
i : thế của điện trường do ion trung tâm
r
eZ
o
oi
i
4
0
1
4
r
r
o
oi
a
r
eeZ
o
oi
a
eZ
4
1/ : bán kính bầu khí
quyển ion](https://image.slidesharecdn.com/baigiangchuong3-150103215336-conversion-gate02/85/Bai-giang-chuong-3-25-320.jpg)




![33
lim[ - i]ra
)1(4
1
a
eeZ
A
a
o
oi
IaB
IhZZ
a
IhZZ
1
.
1
.
lg
B = /I1/2)
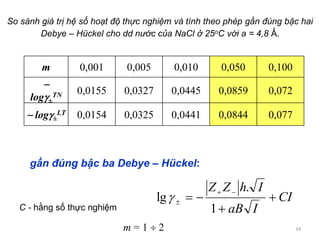
Dd nước NaCl 0,1 m, 25oC a = 4,8 Ǻ
I
IhZZ
1
.
lgGuntenberg
1-1, nước ở 25oC
a 3,04 Ǻ, a.B 1](https://image.slidesharecdn.com/baigiangchuong3-150103215336-conversion-gate02/85/Bai-giang-chuong-3-33-320.jpg)