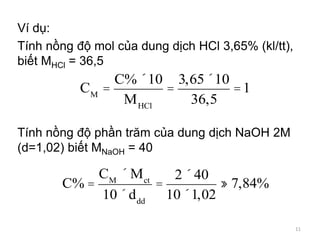
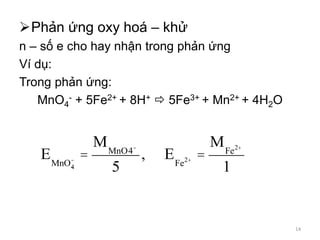
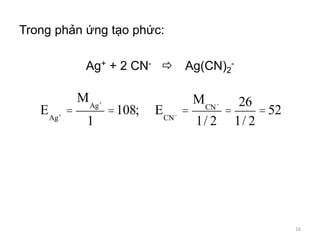
Tài liệu cung cấp các khái niệm cơ bản về dung dịch, bao gồm định nghĩa, thành phần, nồng độ phần trăm và nồng độ mol. Các công thức tính toán liên quan đến nồng độ và ví dụ cụ thể được nêu để minh họa cách xác định nồng độ cũng như mối liên hệ giữa các loại nồng độ. Ngoài ra, tài liệu cũng đề cập đến các khái niệm về nồng độ đương lượng và ứng dụng trong các phản ứng hóa học.