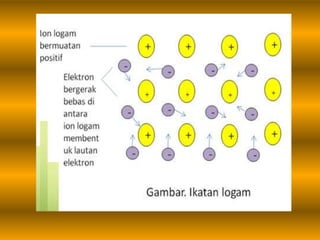
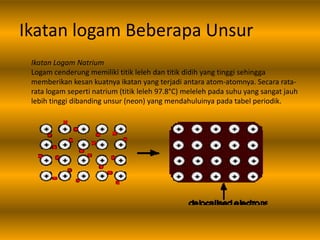
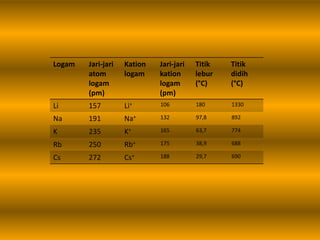
Dokumen tersebut membahas tentang ikatan logam, termasuk pengertian ikatan logam, pembentukan ikatan logam, sifat-sifat logam seperti titik leleh dan didih, konduktivitas listrik dan panas, serta pembentukan aloi. Ikatan logam terbentuk ketika elektron valensi logam berbagi untuk membentuk awan elektron yang mengikat ion-ion logam positif.