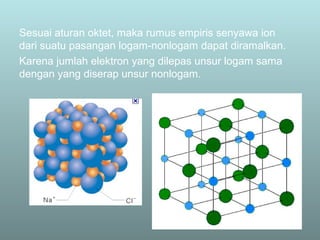
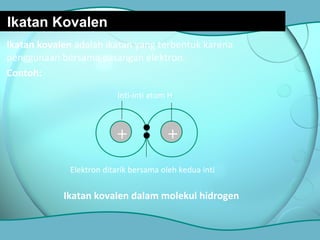
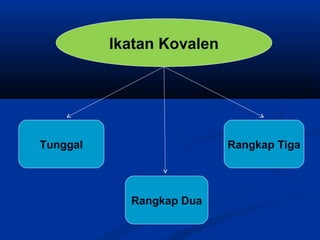
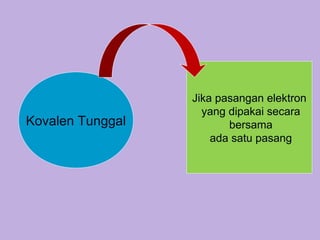
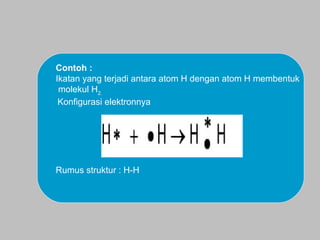
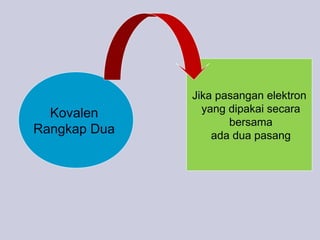
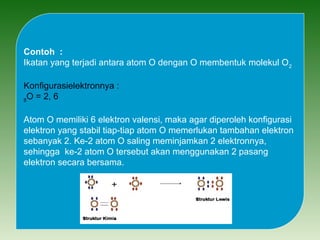
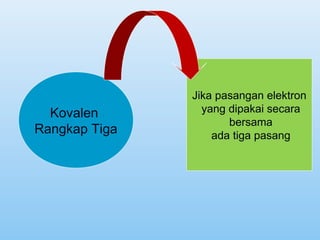
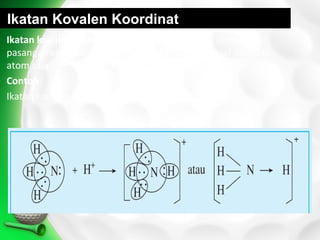
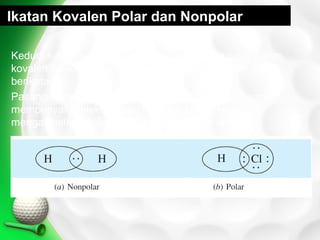
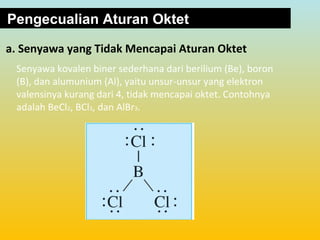
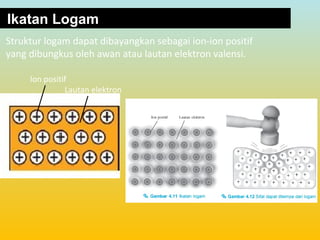
Dokumen ini membahas tentang ikatan kimia, termasuk ikatan ion dan ikatan kovalen, serta karakteristik dan pembentukannya. Ditekankan pentingnya konfigurasi elektron dan aturan oktet dalam pembentukan ikatan, di mana ikatan kovalen melibatkan penggunaan bersama pasangan elektron. Selain itu, dijelaskan perbandingan sifat senyawa ion dan senyawa kovalen serta pengecualian aturan oktet.