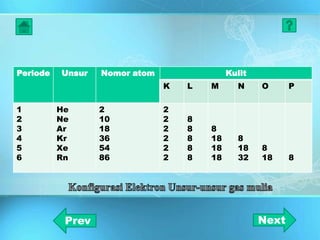
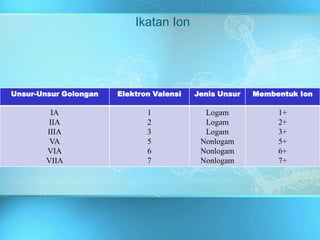
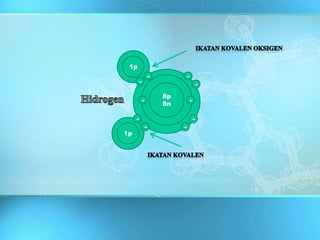
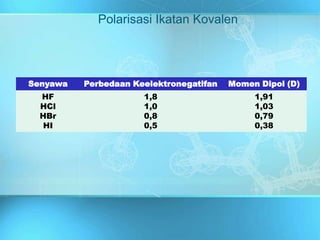
Dokumen ini adalah media pembelajaran interaktif yang dirancang untuk memudahkan proses belajar mengajar berbasis teknologi informasi, dengan materi yang mencakup ikatan kimia dan jenis-jenisnya, termasuk ikatan ion dan ikatan kovalen. Dijelaskan bahwa ikatan ini dibentuk melalui interaksi antara atom-atom dengan fokus pada stabilitas konfigurasi elektron dan bagaimana unsur-unsur mencapai konfigurasi oktet. Penjelasan diakhiri dengan contoh dan konsep dasar yang berkaitan dengan ikatan logam dan sifat-sifat senyawa yang terbentuk.