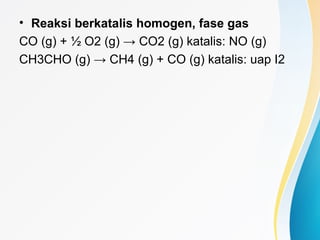
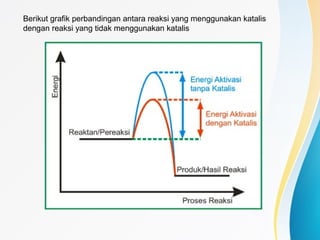
Dokumen tersebut membahas tentang katalis, yaitu zat yang mempercepat laju reaksi kimia tanpa ikut serta dalam reaksi. Dibahas pula tentang jenis, sifat, dan mekanisme kerja katalis serta faktor-faktor yang dapat menyebabkan deaktivasi katalis seperti peracunan, pengerakkan, dan penggumpalan.