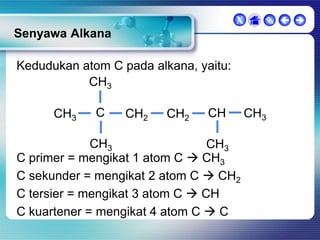
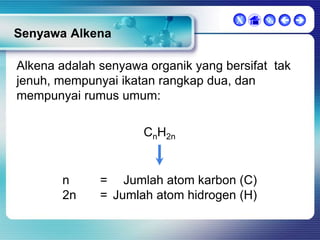
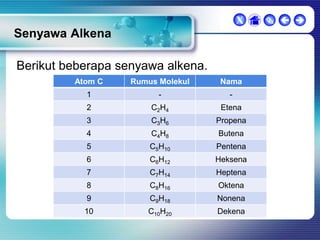
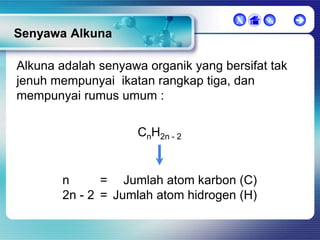
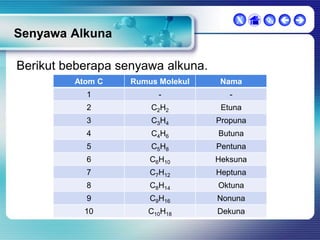
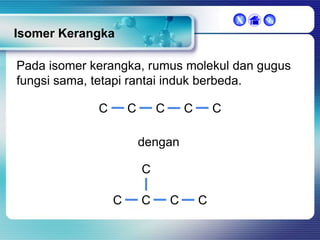
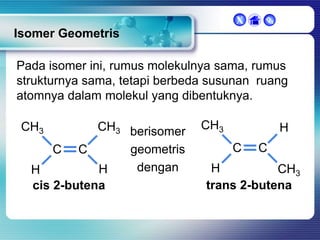
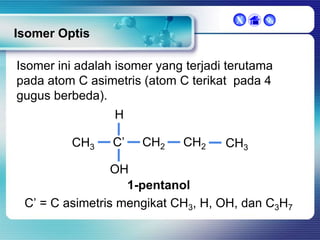
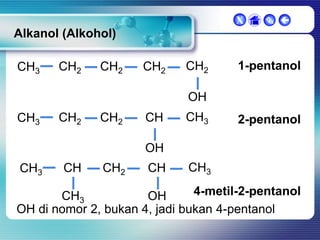
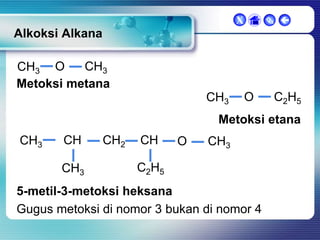
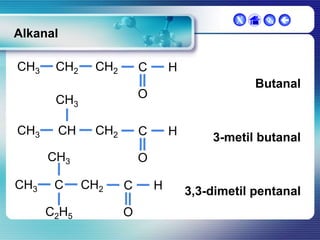
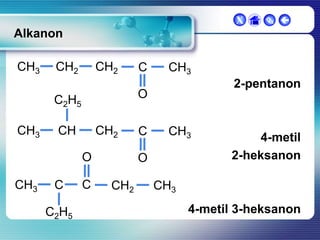
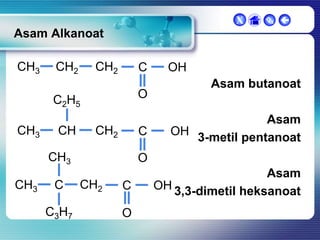
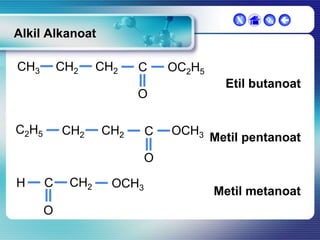
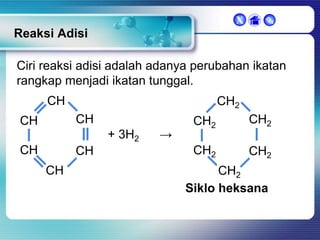
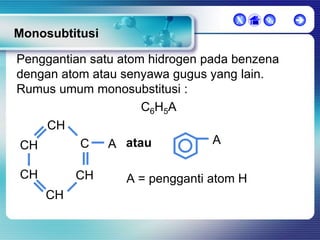
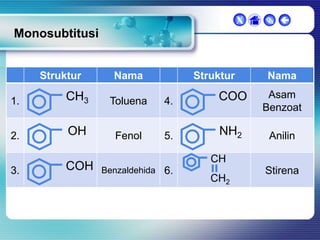
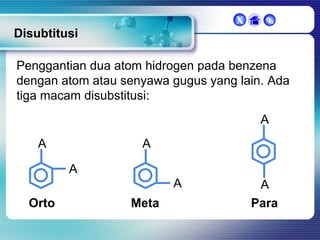
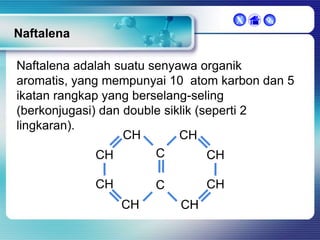
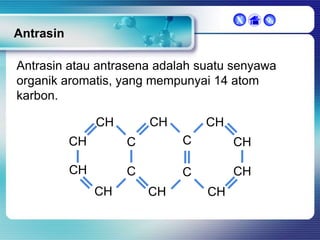
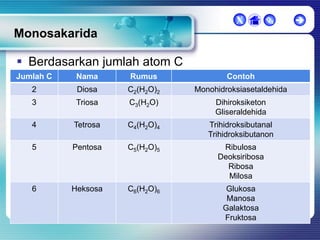
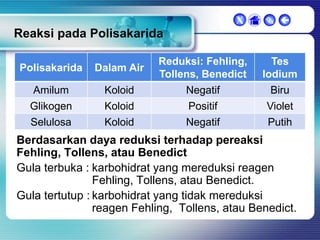
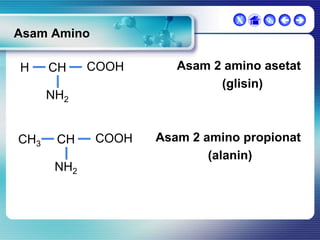
Dokumen ini membahas tentang senyawa organik, termasuk senyawa alifatik dan siklik, serta isomer dan gugus fungsi yang menentukan sifat-sifat senyawa. Setiap jenis senyawa, seperti alkana, alkena, dan alkuna, dijelaskan bersama contoh dan aturan penamaan menurut IUPAC. Selain itu, aspek biokimia dan nutrisi yang diperlukan oleh tubuh juga diuraikan.