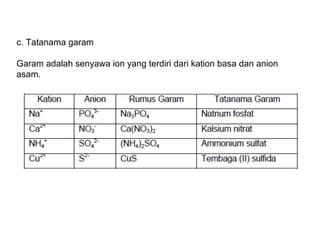
Dokumen ini membahas rumus kimia dan tatanama senyawa kimia, termasuk pengklasifikasian senyawa menjadi anorganik dan organik. Tata nama diatur oleh IUPAC untuk memastikan konsistensi di seluruh dunia, dengan berbagai aturan untuk penamaan senyawa berdasarkan kompleksitasnya. Terdapat juga penjelasan mengenai rumus empiris, rumus molekul, dan penamaan senyawa biner, serta struktur asam, basa, dan garam.