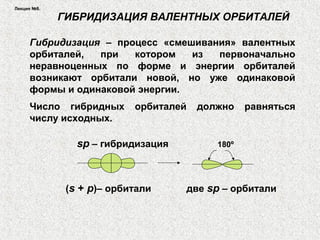
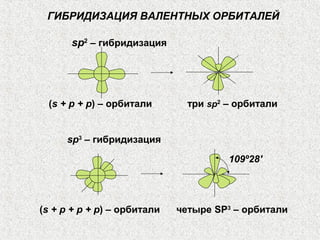
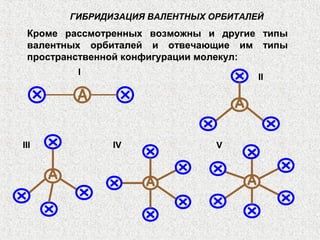
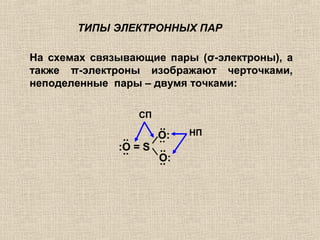
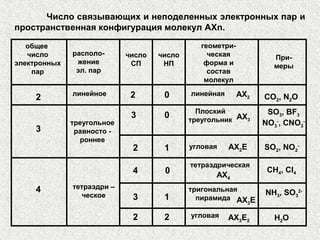
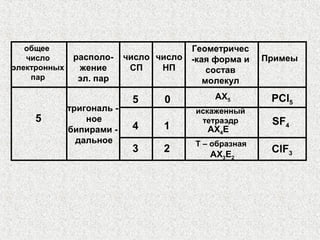
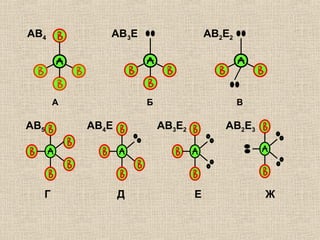
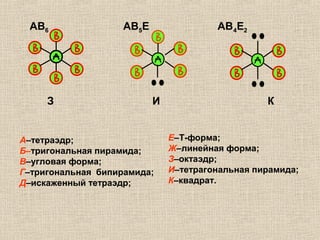
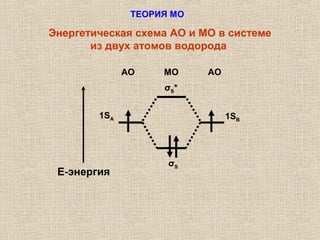
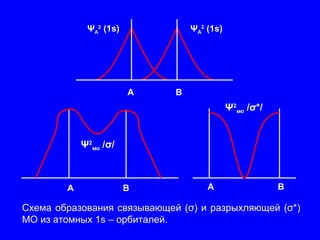
Лекция посвящена гибридизации валентных орбиталей, описывающей процесс создания новых орбитальных форм с одинаковой энергией. Рассматриваются типы гибридизации (sp, sp2, sp3 и другие) и их влияние на геометрию молекул, а также роль электронных пар и отталкивания между ними. Также объясняется теория молекулярных орбиталей и взаимодействие атомных орбиталей при создании молекул.