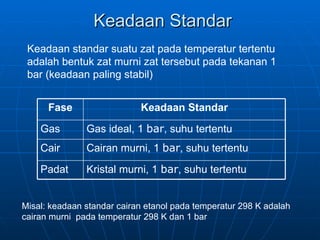
Dokumen tersebut membahas tentang termokimia yang mempelajari perubahan panas pada reaksi kimia dan perubahan fisika. Termasuk definisi entalpi, hubungan entalpi dan energi, hukum Hess, dan jenis-jenis perubahan panas seperti panas reaksi, atomisasi, penguapan, dan ikatan kimia.