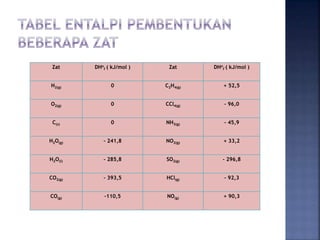
Perubahan entalpi adalah perubahan panas dalam reaksi pada suhu dan tekanan tetap, yang dihitung sebagai selisih antara entalpi produk dan reaktan. Hukum Hess menyatakan bahwa perubahan entalpi hanya bergantung pada keadaan awal dan akhir reaksi. Energi ikatan adalah kalor yang diperlukan untuk memutuskan ikatan dalam molekul, dan dapat dihitung menggunakan data entalpi pembentukan dan energi disosiasi ikatan.