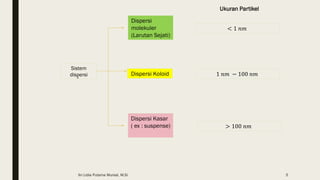
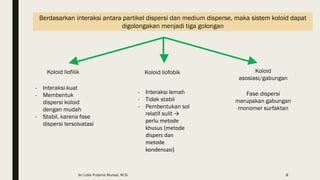
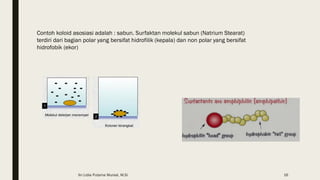
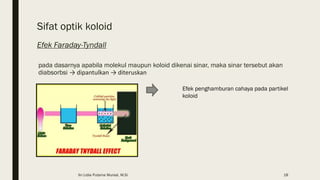
Dokumen ini membahas tentang koloid, termasuk definisi, jenis, dan sifat-sifatnya. Koloid dikelompokkan menjadi tiga kategori berdasarkan ukuran partikel dan fase terdispersinya, yaitu sol, emulsi, dan busa. Selain itu, sistem koloid juga dianalisis dari interaksi antara partikel dan medium disperse, dengan penjelasan tentang mekanisme seperti gerak Brown, difusi, tekanan osmotik, dan koagulasi.