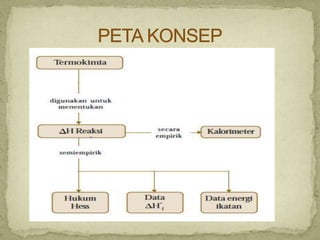
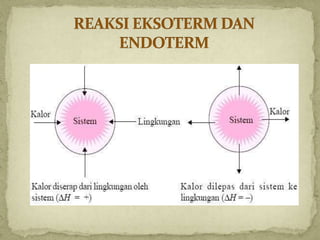
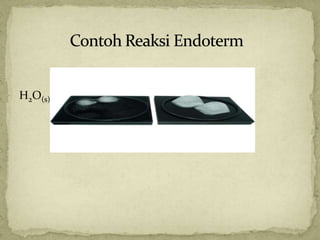
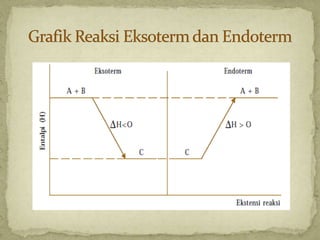
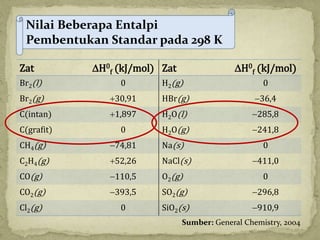
Dokumen ini membahas tentang termokimia, termasuk konsep entalpi dan hukum kekekalan energi dalam reaksi kimia. Penjelasan menyeluruh mengenai reaksi eksoterm dan endoterm, serta penggunaan kalorimeter untuk menentukan kalor reaksi diberikan dalam konteks pembelajaran kimia. Beberapa contoh soal dan perhitungan juga disertakan untuk mendemonstrasikan penerapan prinsip-prinsip tersebut.