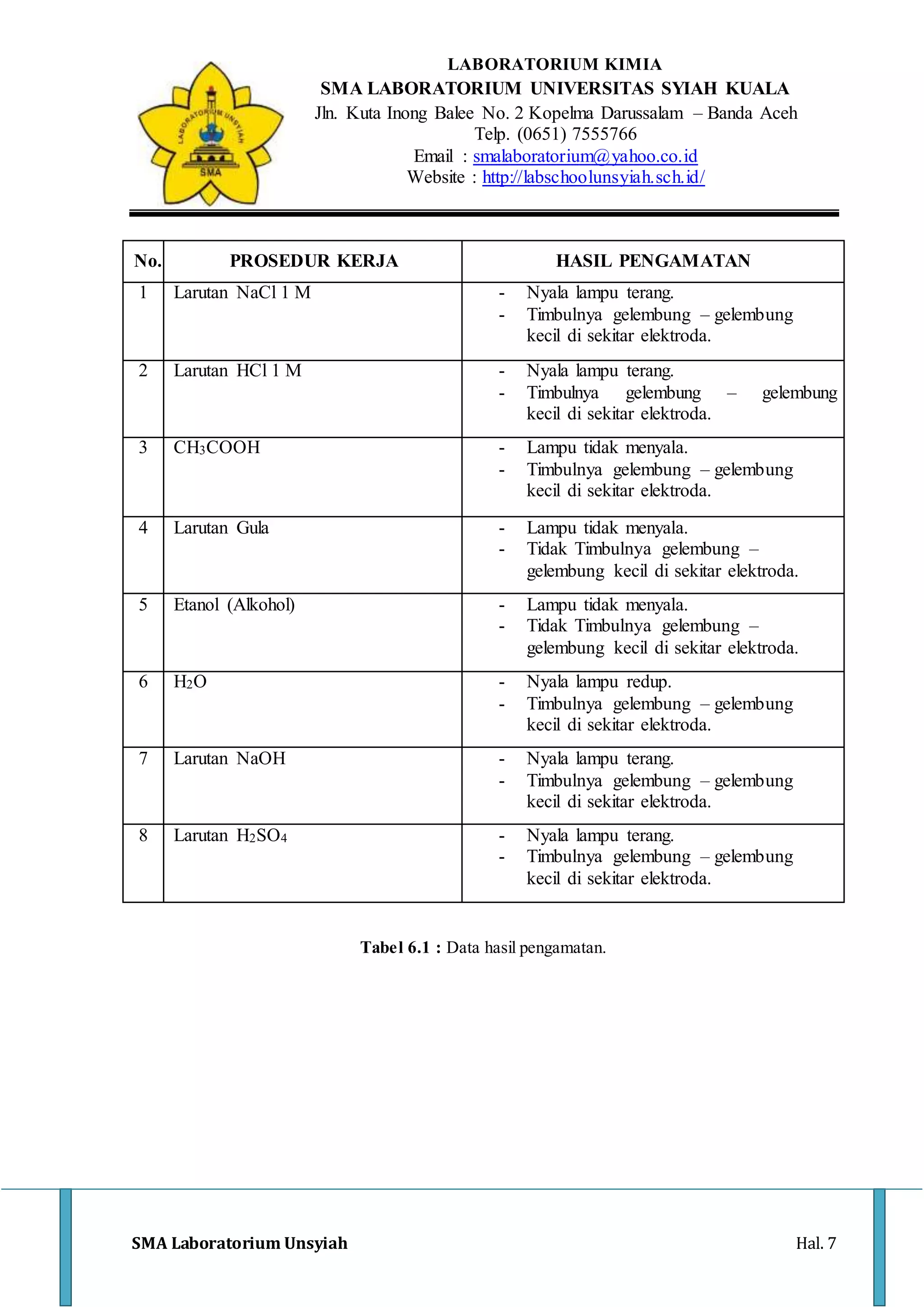
Dokumen ini membahas percobaan mengenai larutan elektrolit dan non-elektrolit di laboratorium kimia, termasuk tujuan, manfaat, dan prosedur kerja yang dilakukan. Siswa diharapkan dapat membedakan dan memahami reaksi ionisasi dari masing-masing larutan yang diuji, seperti HCl dan NaCl sebagai elektrolit kuat, serta CH3COOH dan air yang berfungsi sebagai elektrolit lemah. Hasil percobaan menunjukkan perbedaan penting dalam daya hantar listrik antara larutan-larutan yang diuji.