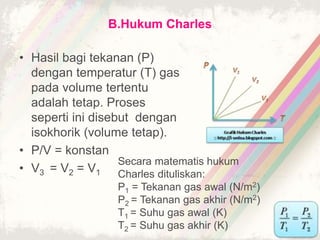
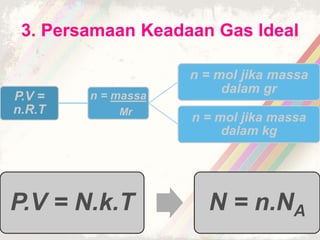
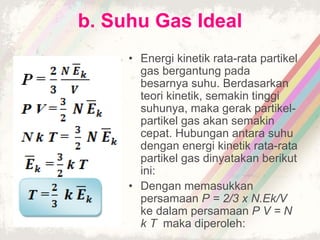
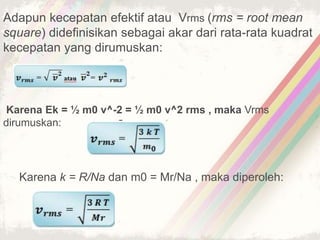
Dokumen ini membahas teori kinetik gas, termasuk definisi gas ideal dan hukum-hukum penting seperti hukum Boyle, Charles, dan Gay-Lussac. Juga dijelaskan persamaan keadaan gas ideal dan konsep tekanan serta energi kinetik dalam gas. Terdapat beberapa soal yang berkaitan dengan penerapan teori tersebut dalam perhitungan gas.