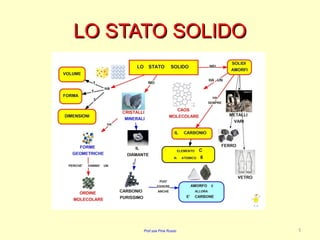
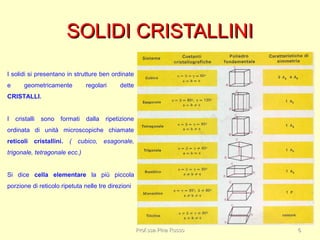
Il documento discute le caratteristiche dei solidi, evidenziando la distinzione tra solidi cristallini e solidi amorfi. I solidi cristallini hanno una struttura ordinata e sono classificati in solidi ionici, covalenti, molecolari e metallici, ognuno con proprietà uniche riguardanti la fusione, durezza e conducibilità. I solidi amorfi, al contrario, non hanno una struttura definita e presentano una disposizione disordinata delle particelle.