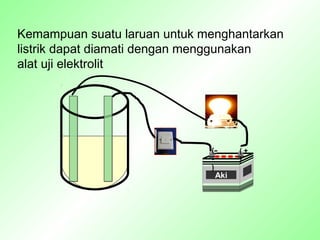
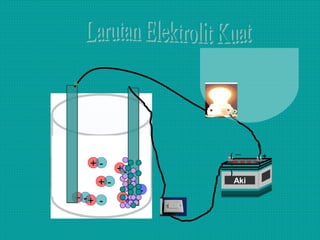
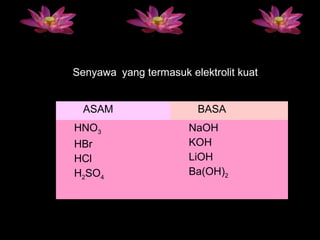
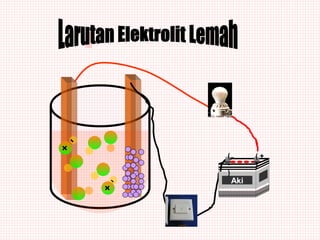
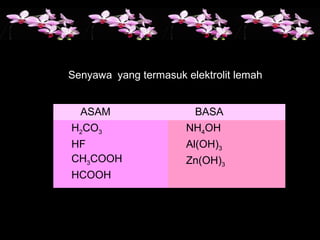
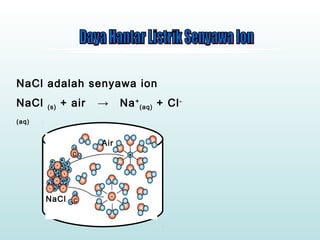
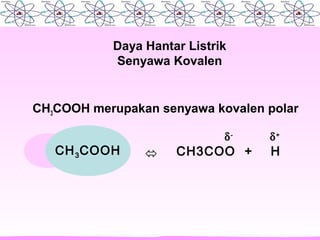
Dokumen ini membahas sifat larutan elektrolit dan non-elektrolit, serta kemampuan menghantarkan arus listrik. Larutan elektrolit dibagi menjadi kuat dan lemah berdasarkan ionisasi, sedangkan larutan non-elektrolit tidak dapat menghantarkan listrik. Contoh dan pengamatan daya hantar listrik dari berbagai larutan juga disajikan.