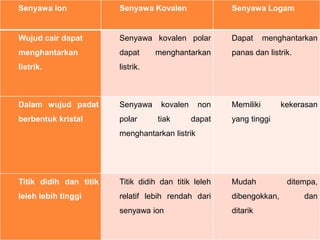
Dokumen ini membahas ikatan kimia, termasuk definisi, tujuan pembentukannya, dan berbagai jenis ikatan yang terjadi antar atom atau molekul. Penjelasan mencakup teori oktet dan duplet, struktur Lewis, serta perbandingan sifat fisik dari senyawa yang terbentuk melalui ikatan ion, kovalen, dan logam. Juga terdapat contoh pertanyaan untuk aplikatif yang berkaitan dengan ikatan kimia.















![1. Senyawa Kovalen Polar
Ikatan kovalen bersifat polar apabila
distribusi elektron ikatan yang ada
tidak persis terletak di tengah-tengah
kedua atom yang berikatan.
senyawa kovalen polar merupakan
senyawa yang minimal tersusun atas 2
(dua) atom yang berbeda seperti
misalnya asam klorida (HCl).
]](https://image.slidesharecdn.com/ikatankimia-150131020959-conversion-gate01/85/Ikatan-kimia-16-320.jpg)