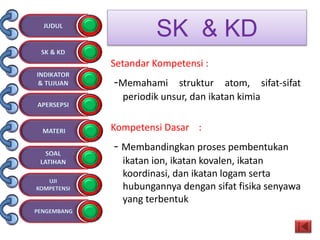
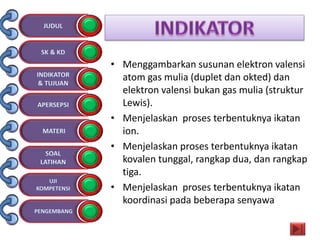
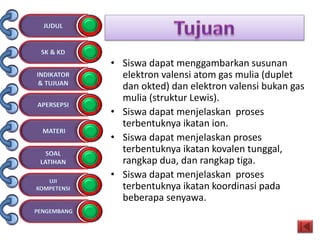
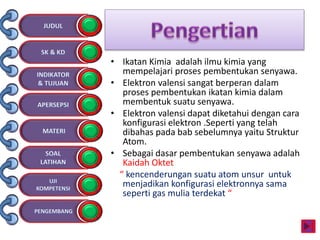
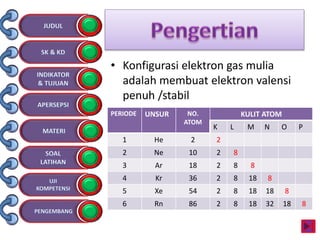
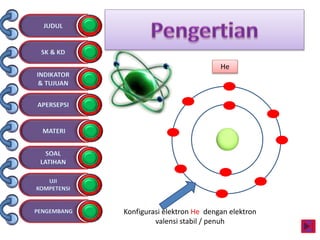
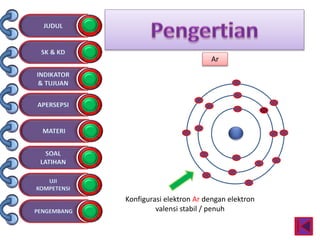
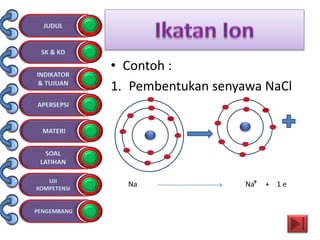
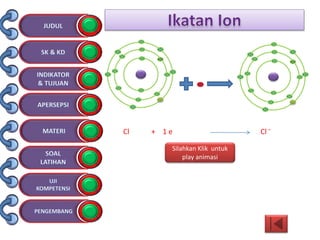
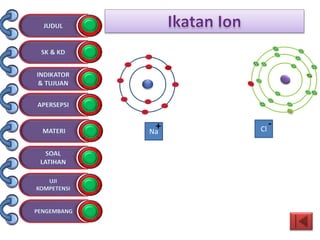
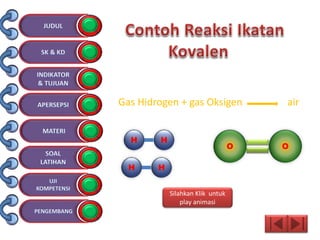
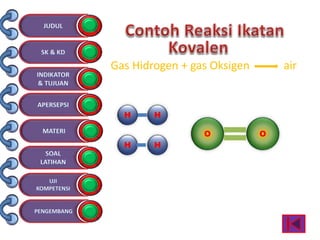
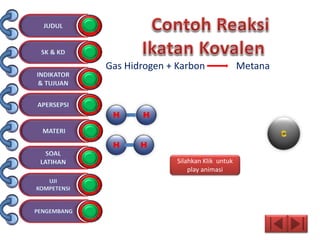
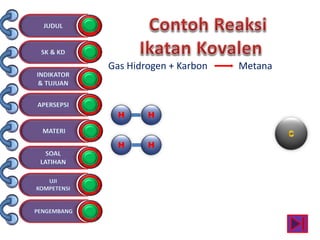
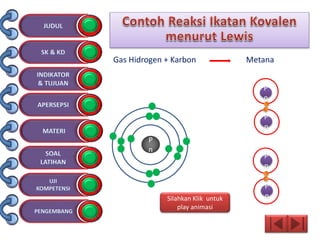
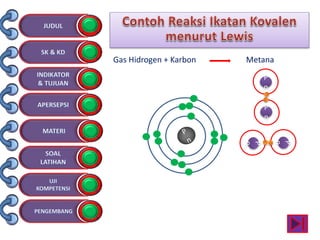
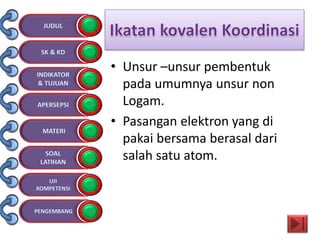
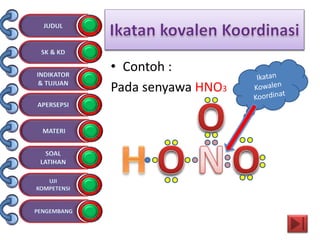
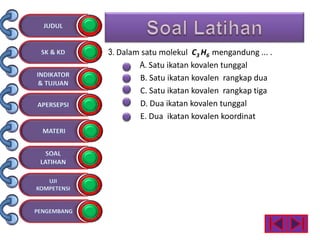
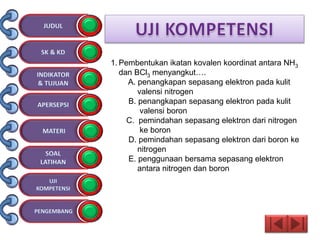
Dokumen tersebut membahas tentang ikatan kimia yang mencakup struktur atom, ikatan ion, ikatan kovalen, dan ikatan koordinasi serta hubungannya dengan sifat fisika senyawa. Dokumen ini juga menjelaskan proses pembentukan berbagai jenis ikatan kimia dan contoh-contoh senyawanya.