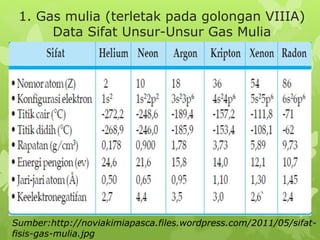
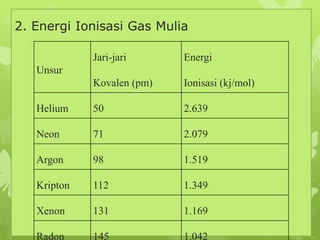
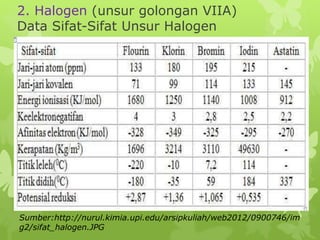
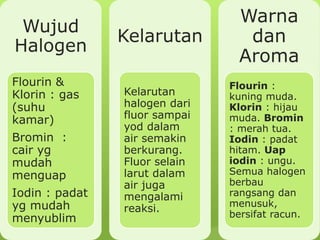
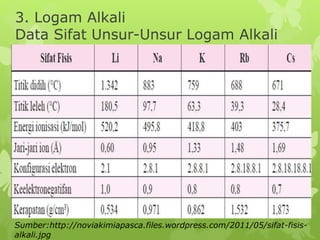
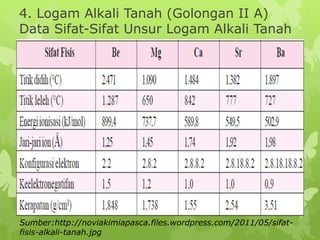
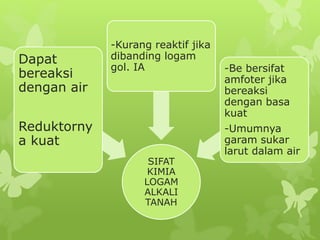
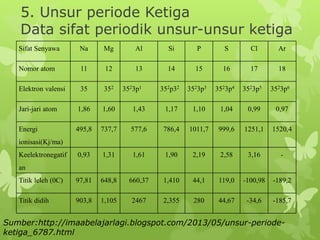
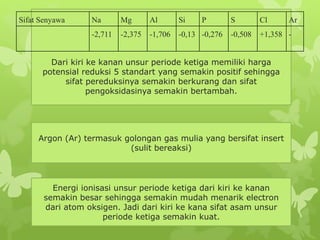
Dokumen ini membahas sifat-sifat fisika dan kimia dari berbagai unsur kimia, termasuk gas mulia, halogen, logam alkali, dan logam alkali tanah, serta karakteristik unsur periode ketiga. Unsur gas mulia cenderung inert dengan titik didih dan energi ionisasi yang rendah, sedangkan halogen merupakan pengoksidasi kuat yang sangat reaktif. Logam alkali dan logam alkali tanah memiliki sifat reaktif dan membentuk berbagai senyawa ketika berinteraksi dengan air dan halogen.