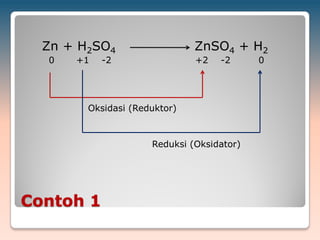
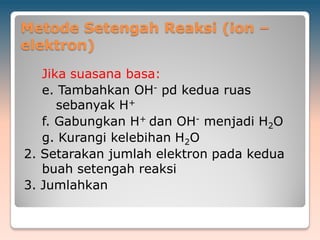
Dokumen ini membahas reaksi redoks, termasuk konsep bilangan oksidasi untuk berbagai unsur dan contoh reaksi kimia yang melibatkan oksidasi dan reduksi. Selain itu, dokumen menjelaskan metode penyetaraan reaksi redoks dalam suasana asam dan basa serta langkah-langkahnya. Contoh-contoh spesifik disertakan untuk menggambarkan proses ini dengan jelas.