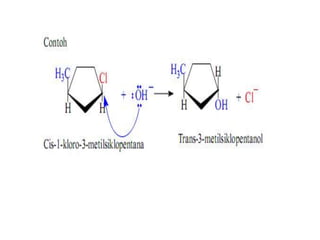
Alkena adalah senyawa hidrokarbon tak jenuh dengan rumus umum CnH2n, yang memiliki ikatan rangkap. Penamaan dan isomer pada alkena dipengaruhi oleh posisi ikatan, posisi cabang, dan perbedaan kerangka karbon, dengan adanya stereoisomer dan isomer geometrik. Selain itu, alkena dapat memiliki konfigurasi cis/trans tergantung pada letak gugus di sekitar ikatan rangkap.












![ISOMER GEOMETRIK
[ ISOMER CIS-TRANS]
• Isomer ini khusus terjadi pada senyawa alkena yang memiliki
struktur :
o Δ
C1 = C2
Δ ♥
C1 = mengikat gugus yang berbeda
C2 = mengikat gugus yang berbeda
gugus yang dikiri harus sama dengan gugus
yang ada dikanan.](https://image.slidesharecdn.com/hidrokarbon-2-alkena-240123071543-aca79663/85/hidrokarbon-2-alkena-ppt-14-320.jpg)