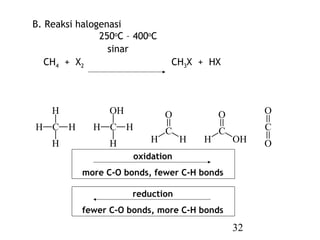
Alkana adalah senyawa organik yang tidak mengandung gugus fungsi dan umumnya nonpolar serta tidak reaktif. Mereka dapat diubah menjadi lebih berguna dalam sintesis organik melalui fungsionalisasi, yaitu penambahan gugus fungsi ke rantai karbon mereka. Reaksi utama alkana termasuk pembakaran, halogenasi, oksidasi, dan reduksi.












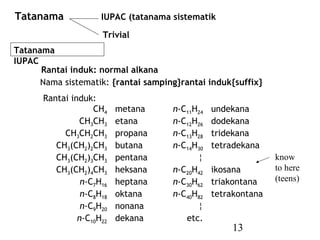











![27
Penentuan bilangan oksidasi ]
1. Untuk setiap atom dalam ikatan, atom elektropositif
bilangan oksidasinya +1, dan atom yang elektronegatif
bilangan oksidasi -1
(If the atoms are the same, each atom gets a 0.)
2. Jumlah atom total
.
C O
Cl
-1+1
-1+1
H
-1
-1
+1
+1
C O
Cl
-1+1
-1+1
H
-1
-1
+1
+1 Oxidation number of carbon is
+1 +1 +1 -1 = +2](https://image.slidesharecdn.com/alkana-140429020720-phpapp02/85/Alkana-27-320.jpg)