Bai giang hoa vo co by nvhoa102
- 1. Chương II nvhoa102@gmail.com 1 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me)
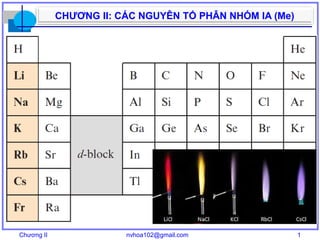
- 2. Chương II nvhoa102@gmail.com 2 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) NỘI DUNG NHẬN XÉT CHUNG I. ĐƠN CHẤT 1. Lý tính 2. Hóa tính 3. Trạng thái tự nhiên, điều chế, ứng dụng II. HỢP CHẤT 1. Các oxit, peoxit, supeoxit, hydroxit 2. Các muối TÀI LIỆU [1] – Tập 2, Chương 2: trang 31 – 48 [2] – Chương 9: trang 202 – 210 [3] – Phần 1, Chương 2: trang 15 – 67 [4] – Chapter 11: page 326 – 347
- 3. Chương II nvhoa102@gmail.com 3 NHẬN XÉT CHUNG • Cấu hình electron hóa trị của Me: ns1 Tính chất đơn giản nhất Thể hiện tính khử mạnh (KL điển hình) Me – e ion Me+ • Me2O, MeOH: bazơ mạnh (KL kiềm) • Các Me+: dễ tan • Li Cs: R , n , hiệu ứng chắn , hiệu ứng xâm nhập ⇒ Tính KL ; Tính bazơ của các Me2O, MeOH CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me)
- 4. Chương II nvhoa102@gmail.com 4 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) I. ĐƠN CHẤT 1. Lý tính • Màu sắc: trắng bạc, có ánh kim rất mạnh. • Rất mềm. • Cấu trúc mạng: lập phương tâm khối. • Khi đốt kim loại hoặc hợp chất dễ bay hơi cho ngọn lửa có màu đặc trưng. • Dễ tan lẫn vào nhau và dễ tạo hỗn hóng với Hg, hỗn hóng natri dùng làm chất khử mạnh. • Tan trong amoniac lỏng.
- 5. Chương II nvhoa102@gmail.com 5 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) , -1.cm-1 I1, eV tnc,, 0C ts, 0C E0 , V d, g/cm3 Li 11,8.104 5,39 180,5 1347 -3,04 0,53 Na 23,0.104 5,14 97,8 881 -2,71 0,97 K 15,9.104 4,34 63,2 766 -2,93 0,86 Rb 8,9.104 4,18 39,0 688 -2,98 1,53 Cs 5,6.104 3,89 28,5 705 -3,03 1,87 Bảng 2.1 Các đại lượng vật lý của các kim loại Me
- 6. Chương II nvhoa102@gmail.com 6 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) 2. Hóa tính Tính khử mạnh, tăng dần từ Li đến Cs: • Phản ứng với hydro 2Me + H2 2MeH (muối rắn, bị thủy phân) • Phản ứng với oxi 4Li + O2 2Li2O 2Na + O2 Na2O2 ( ) Me’ (K, Rb, Cs) + O2 Me’O2 ( ) (Rb, Cs tự bốc cháy) to
- 7. Chương II nvhoa102@gmail.com 7 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) • Phản ứng với halogen Me + ½(F2, Cl2) MeF, MeCl (tự bốc cháy khi có mặt hơi ẩm ở to thường) Me + ½Br2 lỏng MeBr (Li, Na chỉ phản ứng ở bề mặt; K, Rb, Cs gây nổ) Me + ½I2 MeI (chỉ phản ứng mạnh khi đun nóng) • Phản ứng với nước Me + H2O MeOH + ½H2 (Li– mạnh; Na– mãnh liệt; K– bốc cháy; Rb, Cs– nổ)
- 8. Chương II nvhoa102@gmail.com 8 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) 3. Trạng thái tự nhiên, điều chế: - Na, K phổ biến nhất trong nhóm IA: Nước biển, khoáng alumosilicat, muối kép (Kainit – KCl.MgSO4.3H2O; Carnalit – KCl.MgCl2.6H2O; Silvinit – KCl.NaCl) - Điều chế: • Li: điện phân nóng chảy LiCl + KCl KCl LiCl
- 9. Chương II nvhoa102@gmail.com 9 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) • Rb, Cs: 2RbCl + Ca → CaCl2 + 2Rb 7000C P chân không 6060C • Na: Điện phân nóng chảy NaCl hoặc NaOH • K: Dùng Fe khử KOH ở nhiệt độ cao: t0 cao P rất bé 4KOH + 3Fe Fe3O4 + 4K + 2H2 %mol: 60,5 NaCl – 22,5 KCl – 17 NaF
- 10. Chương II nvhoa102@gmail.com 10 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) II. HỢP CHẤT 1. Các oxit, peoxit, supeoxit, hydroxit • Các oxit – Me2O - Điều chế: Li + O2 Li2O Na + O2 Na2O2 Na2O2 + Na 2Na2O Me’ (K, Rb, Cs) + O2 Me’O2 Me’O2 + 3 Me’ 2 Me’2O - Tính chất: Me2O + H2O 2MeOH (phản ứng mạnh và tỏa nhiều nhiệt, trừ Li2O)
- 11. Chương II nvhoa102@gmail.com 11 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) • Các peoxit – Me2O2 - Bền nhiệt - Bị phân hủy trong nước ở to thấp hoặc axit H2O2 Na2O2 + H2SO4 Na2SO4 + H2O2 Na2O2 + 2H2O 2NaOH + 2H2O2 - Oxi hóa mạnh 2FeS2 + 15Na2O2 Fe2O3 + 4Na2SO4 + 11Na2O - Ứng dụng 2Na2O2 + 2CO2 2Na2CO3 + O2 2Na2O2 + H2O + CO2 Na2CO3 + H2O2
- 12. Chương II nvhoa102@gmail.com 12 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) • Các supeoxit – MeO2 - Bền nhiệt - Bị phân hủy trong nước hoặc axit H2O2 + O2 KO2 + H2SO4 K2SO4 + H2O2 + O2 KO2 + 2H2O 2KOH + 2H2O2 + O2 - Oxi hóa mạnh 2KO2 + CO K2CO3 + O2 • Ozonit – KO3 4O3 + 6KOH 4KO3 + 2KOH.H2O + O2
- 13. Chương II nvhoa102@gmail.com 13 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) • Các hydroxit – MeOH - Bazo mạnh, tăng dần từ LiOH đến CsOH - Bền nhiệt (trừ LiOH) - Hút ẩm mạnh - Tan nhiều trong nước và rượu, tỏa nhiệt mạnh. 2. Muối halogenua - Dễ tan (trừ LiF) - NaCl: muối ăn, điều chế Na, NaOH, Cl2, HCl, nước Javel … - KCl: phân kali, điều chế KOH, KClO3 …
- 14. Chương II nvhoa102@gmail.com 14 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) 3. Muối bicacbonat, cacbonat • Bicacbonat – MeHCO3 - Không bền nhiệt, ít tan trong nước. • Cacbonat – Me2CO3 (Na2CO3 - Soda): - Bền nhiệt, tan trong nước cho môi trường kiềm yếu. - Riêng Li2CO3 ít tan. - Ứng dụng: sản xuất xà phòng, thủy tinh, giấy, sợi… - Điều chế soda theo phương pháp Solvay.
- 15. Chương II nvhoa102@gmail.com 15 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) Hình 2.1 Quy trình điều chế soda theo pp Solvay
- 16. Chương II nvhoa102@gmail.com 16 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me)
- 17. Chương II nvhoa102@gmail.com 17 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) CÂU HỎI ÔN TẬP 1. Các kim loại kiềm có những đặc điểm chung gì? Giải thích tại sao? 2. Các tính chất vật lý đặc trưng của các kim loại kiềm và giải thích? 3. Tại sao kim loại kiềm có tính khử mạnh và tính khử tăng dần? Lấy các phản ứng minh họa. 4. Các phương pháp điều chế kim loại kiềm? 5. Nguyên tắc điều chế các Me2O và cho biết tính chất đặc trưng của chúng?
- 18. Chương II nvhoa102@gmail.com 18 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) CÂU HỎI ÔN TẬP 6. Peoxit đặc trưng cho pepoxit kim loại kiềm là gì? Nó có tính chất gì? 7. Cho biết những điểm giống nhau và khác nhau giữa supeoxit kim loại kiềm với peoxit và ozonit? 8. Các MeOH có độ tan, độ bền, độ bazo như thế nào? 9. Các muối đặc trưng của Me có độ tan, độ bền như thế nào? Cho biết ứng dụng của chúng?
- 19. Chương II nvhoa102@gmail.com 19 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) CÂU HỎI CHUẨN BỊ BÀI MỚI 1. Các kim loại kiềm thổ (M) có những đặc điểm chung gì? 2. Tính chất vật lý và hóa học của M giống và khác Me như thế nào? Tại sao? 3. Các khoáng chất thường gặp của M? 4. Nguyên tắc điều chế M? 5. Các hợp chất của M có độ tan, độ bền, tính bazo [đối với M(OH)2] như thế nào? Chúng khác gì so với các hợp chất của Me.
- 20. Chương III nvhoa102@gmail.com 1 CHƯƠNG III: CÁC NGUYÊN TỐ PHÂN NHÓM IIA (M)
- 21. Chương III nvhoa102@gmail.com 2 CHƯƠNG III: CÁC NGUYÊN TỐ PHÂN NHÓM IIA (M) NỘI DUNG NHẬN XÉT CHUNG I. ĐƠN CHẤT 1. Lý tính 2. Hóa tính 3. Trạng thái tự nhiên, điều chế, ứng dụng II. HỢP CHẤT 1. Các oxit, peoxit, hydroxit 2. Các carbua và muối TÀI LIỆU [1] – Tập 2, Chương 3: trang 49 – 69 [2] – Chương 8: trang 185 – 201 [3] – Phần 1, Chương 3: trang 68 – 96 [4] – Chapter 12: page 348 – 370
- 22. Chương III nvhoa102@gmail.com 3 NHẬN XÉT CHUNG - Cấu hình electron hóa trị: ns2 Nhường e thể hiện tính khử (kém hơn kim loại kiềm): M – 2e M2+ - Tính kim loại, tính khử: tăng dần Be Ba - Hơi của M chỉ gồm phân tử một nguyên tử - Các oxit, hydroxit: bazo mạnh, tăng dần từ Be Ba - Chỉ Be+2 và Mg+2 có khả năng tạo phức - Trong các hợp chất: Be chủ yếu tạo liên kết CHT, Ca Ba chủ yếu tạo liên kết ion. CHƯƠNG III: CÁC NGUYÊN TỐ PHÂN NHÓM IIA (M)
- 23. Chương III nvhoa102@gmail.com 4 I. ĐƠN CHẤT 1. Lý tính: màu sắc, độ cứng, màu ngọn lửa CHƯƠNG III: CÁC NGUYÊN TỐ PHÂN NHÓM IIA (M) Rk (Å) I1 (eV) I2 (eV) tnc (0C) ts (0C) 0 M 2+ /M Cấu trúc mạng tinh thể Be 1,13 9,32 18,21 1287 2767 -1,85 Lục phương Mg 1,60 7,65 15,04 650 1107 -2,37 Lục phương Ca 1,97 6,11 11,87 842 1484 -2,87 Lập phương tâm diện Sr 2,15 5,69 11,03 767 1384 -2,89 Lập phương tâm diện Ba 2,21 5,21 10,00 727 1640 -2,90 Lập phương tâm khối Ra 2,35 5,28 10,15 700 1140 -2,92 Lập phương tâm khối
- 24. Chương III nvhoa102@gmail.com 5 2. Hóa tính Tính khử yếu hơn Me, tăng dần từ Be đến Ra: • Phản ứng với hydro (M’ = Ca, Sr, Ba) M’ + H2 2 M’H2 (hydrua ion) • Phản ứng với không khí M’ + O2 M’O M + O2 MO 3M + N2 M3N2 to CHƯƠNG III: CÁC NGUYÊN TỐ PHÂN NHÓM IIA (M) to phòng to cao to cao
- 25. Chương III nvhoa102@gmail.com 6 • Phản ứng với nước M’ + H2O M’(OH)2 + H2 Mg + H2O Mg(OH)2 + H2 • Phản ứng với cacbon M + C MC2 Riêng Be: Be + C Be2C • Be có tính chất giống Al Be + 2NaOH + 2H2O Na2[Be(OH)4] + H2 Be + 2HCl + 4H2O [Be(H2O)4]Cl2 + H2 Be bị thụ động trong HNO3 đ,nguội; H2SO4 đ,nguội CHƯƠNG III: CÁC NGUYÊN TỐ PHÂN NHÓM IIA (M) to to
- 26. Chương III nvhoa102@gmail.com 7 3. Trạng thái tự nhiên, điều chế: • Khoáng vật của beri: beryl (3BeO.Al2O3.6SiO2) • Khoáng vật của magie: carnalit (KCl.MgCl2.6H2O); dolomit (MgCO3.CaCO3); talc (3MgO.4SiO2.H2O); amiăng (Mg3(Si2O5)(OH)4 … • Khoáng vật của canxi: thạch cao (CaSO4.2H2O); florit (CaF2); apatit (Ca5(PO4)3F) … • Khoáng vật của stronti và bari: xeleotit (SrSO4); strontianit (SrCO3); baritin (BaSO4); viterit (BaCO3) CHƯƠNG III: CÁC NGUYÊN TỐ PHÂN NHÓM IIA (M)
- 27. Chương III nvhoa102@gmail.com 8 CHƯƠNG III: CÁC NGUYÊN TỐ PHÂN NHÓM IIA (M) Điều chế • Nguyên tắc chung: điện phân muối halogenua nóng chảy. • MgO + C Mg + CO CaO + 2MgO + Si 2Mg + CaO.SiO2 • 2Al + 4CaO CaO.Al2O3 + 3Ca • 2Al + 4SrO SrO.Al2O3 + 3Sr • 2Al + 4BaO BaO.Al2O3 + 3Ba 2000 oC 1500 oC 1200 oC 1200 oC 1200 oC
- 28. Chương III nvhoa102@gmail.com 9 II. HỢP CHẤT 1. Các oxit – MO - Điều chế: nhiệt phân các muối cacbonat, nitrat. - Hút ẩm, hấp phụ CO2. M’O + CO2 M’CO3 - Độ tan trong nước BeO BaO. M’O + H2O M’(OH)2 + Q - Tính bazo BeO BaO. CHƯƠNG III: CÁC NGUYÊN TỐ PHÂN NHÓM IIA (M)
- 29. Chương III nvhoa102@gmail.com 10 2. Các peoxit – MO2 - Không bền nhiệt, độ bền BeO2 BaO2 2BaO + O2 ⇌ 2BaO2 - Bị phân hủy trong nước hoặc axit H2O2 BaO2 + H2SO4 BaSO4 + H2O2 BaO2 + 2H2O ⇌ Ba(OH)2 + 2H2O2 - Oxi hóa và khử 2Fe2+ + BaO2 + 4H+ 2Fe3+ + Ba2+ + 2H2O HgCl2 + BaO2 Hg + BaCl2 + O2 CHƯƠNG III: CÁC NGUYÊN TỐ PHÂN NHÓM IIA (M) 4000C 6000C
- 30. Chương III nvhoa102@gmail.com 11 3. Các hydroxit – M(OH)2 - Không bền nhiệt: M(OH)2 MO + H2O - Tính bazo, độ tan, độ bền nhiệt: tăng dần từ Be(OH)2 đến Ba(OH)2 4. Các cacbua - MC2 - Bị thủy phân tạo thành C2H2 MC2 + 2H2O M(OH)2 + C2H2 - Riêng Be2C thủy phân tạo thành CH4 Be2C + 4H2O 2Be(OH)2 + CH4 CHƯƠNG III: CÁC NGUYÊN TỐ PHÂN NHÓM IIA (M) to
- 31. Chương III nvhoa102@gmail.com 12 5. Muối của M • Muối halogenua – MX2 - Dễ tan (trừ MF2) - MgCl2, CaCl2 có tính hút ẩm mạnh • Muối cacbonat – MCO3 - Không bền nhiệt, ít tan trong nước, tan trong nước CO2 CaCO3 + H2O + CO2 Ca(HCO3)2 CHƯƠNG III: CÁC NGUYÊN TỐ PHÂN NHÓM IIA (M)
- 32. Chương III nvhoa102@gmail.com 13 CHƯƠNG III: CÁC NGUYÊN TỐ PHÂN NHÓM IIA (M) • Muối sunfat – MSO4 - Không bền nhiệt, độ tan trong nước giảm dần từ BeSO4 đến BaSO4 CaSO4.2H2O ⇌ CaSO4.0,5H2O + 1,5H2O CaSO4.0,5H2O CaSO4 + 0,5H2O 2CaSO4 2CaO + 2SO2 + O2 125 oC t0 phòng 200 oC 960 oC
- 33. Chương III nvhoa102@gmail.com 14 CHƯƠNG III: CÁC NGUYÊN TỐ PHÂN NHÓM IIA (M) 6. Nước cứng • Là nước có chứa nhiều Ca2+ và Mg2+ (= M’’2+). • Độ cứng của nước được biểu diễn bằng số mđlgCa2+/L. độ cứng < 4 mđlg/L: nước mềm độ cứng > 8 mđlg/L: nước cứng
- 34. Chương III nvhoa102@gmail.com 15 CHƯƠNG III: CÁC NGUYÊN TỐ PHÂN NHÓM IIA (M) Các phương pháp làm mềm nước cứng: - Vật lý (đun sôi): M’’(HCO3)2 M’’CO3 + CO2 + H2O - Hóa học: dùng soda - sữa vôi; Na3PO4 Mg2+ + Ca(OH)2 Mg(OH)2 + Ca2+ Ca2+ + Na2CO3 CaCO3 + 2Na+ - Trao đổi ion: dùng zeolit (Na2Al2Si2O8.xH2O), nhựa trao đổi ion.
- 35. Chương III nvhoa102@gmail.com 16 CHƯƠNG III: CÁC NGUYÊN TỐ PHÂN NHÓM IIA (M) Nhựa trao đổi ion:
- 36. Chương III nvhoa102@gmail.com 17 CHƯƠNG III: CÁC NGUYÊN TỐ PHÂN NHÓM IIA (M) Nhựa cationit và anionit:
- 37. Chương V nvhoa102@gmail.com 1 CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E)
- 38. Chương V nvhoa102@gmail.com 2 CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E) NỘI DUNG NHẬN XÉT CHUNG I. ĐƠN CHẤT II. HỢP CHẤT CÓ SỐ OXH (-4) III. HỢP CHẤT CÓ SỐ OXH (+2), (+4) IV. VẬT LIỆU SILICAT TÀI LIỆU [1] – Tập 2, Chương 5: trang 99 – 160 [2] – Chương 6: trang 142 – 167 [3] – Phần II, Chương 2: trang 129 – 178 [4] – Chapter 14: page 426 – 484
- 39. Chương V nvhoa102@gmail.com 3 NHẬN XÉT CHUNG - Cấu hình electron hóa trị: ns2np2. - Σ I khá lớn không thể mất 4e để tạo nên ion +4. - χ chưa đủ lớn không thể nhận 4e để tạo ion -4. - ⇒ Các hợp chất có số oxi hóa -4, +2, +4 tạo nên những cặp e dùng chung, có bản chất liên kết CHT. - Thể hiện tính oxi hóa và khử. - C Pb: Tính oxihóa , tính khử ; HC (+4), (+2) - C, Si là phi kim – Ge lưỡng kim – Sn, Pb là kim loại. Có khả năng tạo mạch dài E-E, giảm dần từ C Pb CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E)
- 40. Chương V nvhoa102@gmail.com 4 I ĐƠN CHẤT 1 Cacbon 1.1 Tính chất vật lý 2000 4000 60.000 120.000 2800 o K atm Pt Cacbin Graphit Xuùc taùc: Kim cöôngC Kim cương (a); Graphit (b); Cacbin: (=C=C=)n Lonsdaleit (c); Fullerenne (d-C60, e-C540, f-C70); Carbon nanotube (h); Carbon vô định hình (g) (than gỗ, than cốc, muội hóng). 1000 – 1500 oC -graphite CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E)
- 41. Chương V nvhoa102@gmail.com 5 1.2 Tính chất hóa học Ở nhiệt độ cao thể hiện tính khử và oxi hóa - Khử mạnh C + O2 CO2 C + H2O CO + H2 C + 2H2SO4 đặc CO2 + 2SO2 + 2H2O C + NaOH đặc Na2CO3 + CO + H2 + … C + 2S CS2 ; C + Fe2O3 Fe + CO2 - Oxi hóa yếu 2C + 4Al Al4C3 C + H2 CH4 + C2H2 + … CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E)
- 42. Chương V nvhoa102@gmail.com 6 2 Silic 2.1 Tính chất vật lý Có hai dạng thù hình: - Thù hình tinh thể lập phương – sp3, bền: chất rắn có mạng tinh thể giống kim cương; rất cứng, khó nóng chảy, khó bay hơi; có màu xám, ánh kim; có tính bán dẫn kiểu p và kiểu n. (E = 1,12 eV) - Thù hình vô định hình lập phương – sp2 (giống grafit), kém bền hơn. CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E)
- 44. Chương V nvhoa102@gmail.com 8 2.2 Tính chất hóa học Trơ về mặt hóa học. Ở nhiệt độ cao: - Tính khử: Si + 2F2 SiF4 (t0 thường) Si + O2 SiO2 (600 oC) Si + C SiC (200 oC) Si + H2 SiH4 + Si2H6 + Si3H6 … (hồ quang điện) 3Si + 4HNO3 + 18HF = 3H2SiF6 + 4NO + 8H2O Si + 2KOH + H2O = K2SiO3 + 2H2 - Tính oxi hóa: 2Mg + Si Mg2Si (800-900 oC) CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E)
- 45. Chương V nvhoa102@gmail.com 9 2.3 Trạng thái tự nhiên và điều chế - Trạng thái tự nhiên: Cát (SiO2); Silicat (đá, đất sét ...) - Điều chế: CN: SiO2 + 2C 2CO + Si 3SiO2 + 2CaC2 2CaO + 4CO + 3Si PTN: SiO2 + 2Mg 2MgO + Si Si tinh khiết hóa học: SiCl4 + 2Znhơi Si + ZnCl2 SiH4 Si + 2H2 CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E)
- 46. Chương V nvhoa102@gmail.com 10 3 Gecmani, thiếc, chì - Ở nhiệt độ thường, bền trong không khí và nước. Ở nhiệt độ cao, hoạt động hơn: Ge + O2 GeO2 Sn + O2 SnO2 2Pb + O2 2PbO - Ge không tác dụng với kiềm, chỉ tác dụng với axit có tính oxi hóa mạnh (vd HNO3) Ge + 4HNO3 H2GeO3 + 4NO + 2H2O - Sn, Pb tác dụng với axit và kiềm như kim loại 3Pb + 8HNO3 loãng 3Pb(NO3)2 + 2NO + 4H2O Sn + 2NaOH + 2H2O Na2[Sn(OH)4] + H2 CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E)
- 47. Chương V nvhoa102@gmail.com 11 II HỢP CHẤT 1 Các hợp chất của cacbon 1.1 Hợp chất C (-4) – Cacbua - Cacbua phi kim: CxHy, SiC, B4C3 (cacbua CHT) - Cacbua kim loại, gồm: Cacbua ion: chất tinh thể; khó nóng chảy; bị nước, axit phân hủy tạo thành sản phẩm: • CH4, gọi là cacbua metanit (Be2C, Al4C3); Be2C + 4H2O 2Be(OH)2 + CH4 CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E)
- 48. Chương V nvhoa102@gmail.com 12 • C2H2, gọi là cacbua axetylenit – cacbua KL nhóm I và II (Ag2C2, CaC2…) CaC2 + 2HCl CaCl2 + C2H2 • C2H2 & CxHy, gọi là cacbua axetylen và hydro cacbon khác (YC2, LaC2, Ce2C3 ...) 2LaC2 + 6H2O 2La(OH)3 + C2H2 + C2H4 Cacbua xâm nhập: cacbua nguyên tố d: TiC, W2C, Fe3C, VC0,58-1,0 … có ánh kim, dẫn điện, dẫn nhiệt, rất cứng, bền nhiệt, bền hóa. 3WC + 9HNO3 + 18HF 3HWF6 + 3CO2 + 9NO + 12H2O CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E)
- 49. Chương V nvhoa102@gmail.com 13 1.2 Hợp chất C (+2): CO; HCN; CN- Có một số tính chất giống N2: khí không màu, không mùi, khó hóa lỏng, khó hóa rắn, ít tan trong nước, rất bền nhiệt; kém hoạt động ở nhiệt độ thường. CO CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E)
- 50. Chương V nvhoa102@gmail.com 14 700 oC nổ Khác với nitơ, CO: độc; ở nhiệt độ cao khả năng khử tăng lên: 2CO + 1O2 2CO2 , H0 = -283 kJ/mol CO được dùng làm nhiên liệu 3CO + Fe2O3 2Fe + 3CO2 CO + Cl2 COCl2 (chiếu sáng hoặc 500 oC) Photgen: rất độc tạo phức cacbonyl với kim loại chuyển tiếp: Fe + 5CO [Fe(CO)5] (100–200 oC, 150 at) CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E)
- 51. Chương V nvhoa102@gmail.com 15 Ni + 4CO [Ni(CO)4] (50 oC) Cr + 6CO [Cr(CO)6] (t0, p) Dễ bị nhiệt phân giải phóng KL: tinh chế KL - HCN tan vô hạn trong nước (Ka HCN = 2.10-9), rượu, ete; chỉ MeCN và M(CN)2 tan trong nước; - Rất độc; - Có tính khử mạnh và khả năng tạo phức: 4Au + 8NaCN + 2H2O + O2 4Na[Au(CN)2] + 4NaOH HCN và CN- : CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E)
- 52. Chương V nvhoa102@gmail.com 16 CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E) 1.3 Hợp chất C (+4): CO2; H2CO3; HCO3 -; CO3 2- - Khí không màu, có vị chua; - Dễ hóa lỏng, hóa rắn (đá khô); - Không cháy và không duy trì sự cháy Chữa cháy, trừ trường hợp cháy kim loại như Al, Zn, Mg: 4Al + 3CO2 2Al2O3 + 3C - Oxi axit: CO2 + 2NaOH Na2CO3 + H2O - Anhydrit cacbonic: CO2 + H2O ⇌ H2CO3 CO2 :
- 53. Chương V nvhoa102@gmail.com 17 - Gây hiệu ứng nhà kính CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E)
- 54. Chương V nvhoa102@gmail.com 18 - H2CO3 là axit 2 lần và là axit rất yếu: H2O + CO2 ⇌ H2CO3 ⇌ H + HCO3 ̅ ⇌ 2H+ + CO3 2– Ka1 = 4,5.10-7 Ka2 = 5,6.10-11 - Muối CO3 2- của IA (trừ Li2CO3) và muối HCO3 - của IIA đều tan và thủy phân cho dung dịch kiềm yếu. - Muối CO3 2- đều bị nhiệt phân trừ cacbonat IA. CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E) H2CO3 và muối CO3 2- :
- 55. Chương V nvhoa102@gmail.com 19 - H2C2O4: axit 2 lần và là axit trung bình Ka1 = 10-1,23 Ka2 = 10-4,19 H2C2O4 + 2NaOH Na2C2O4 + 2H2O - Có tính khử mạnh 5Na2C2O4 + 2KMnO4 + 8H2SO4 2MnSO4 + K2SO4 + 5Na2SO4 + 10CO2 + 8H2O Sử dụng làm chất gốc trong phân tích. CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E) H2C2O4 và muối C2O4 2- : (axit oxalic và muối oxalat)
- 56. Chương V nvhoa102@gmail.com 20 CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E) 2 Các hợp chất của silic 2.1 Hợp chất Si (-4) – Silixua - Các silixua có liên kết cộng hóa trị, ion, kim loại. - Hydro silixua gọi là silan, công thức SinH2n+2. - Silixua là những chất bán dẫn. - Silixua của nguyên tố s, d nhóm I, II bị nước và axit thủy phân: Ca2Si + 4HCl SiH4 + 2CaCl2
- 57. Chương V nvhoa102@gmail.com 21 CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E) 2.2 Hợp chất Si (+4) Có 3 dạng thù hình tinh thể: SiO2 : - Các thù hình đều bao gồm nhóm tứ diện SiO4, chúng khác nhau về cách sắp xếp nhóm SiO4. - SiO2 dễ chuyển sang trạng thái thủy tinh.
- 58. Chương V nvhoa102@gmail.com 22 CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E) - SiO2 bền về mặt hóa học, chỉ tác dụng: với F2, HF (khí và dung dịch) ở điều kiện thường SiO2 + 2F2 SiF4 + 2O SiO2 + 4HF(k) SiF4 + 2H2O tan trong kiềm hay cacbonat kiềm nóng chảy SiO2 + 2NaOH Na2SiO3 + H2O SiO2 + Na2CO3 Na2SiO3 + CO2 - Các axit silixic có công thức chung xSiO2.yH2O. H2SiO3 :
- 59. Chương V nvhoa102@gmail.com 23 CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E) - Là axit yếu (Ka = 10-10). Không tan trong nước. - Khi mất nước silicagen (SiO2 mịn): dùng làm chất hút ẩm, chất hấp phụ. Muối silicat: - Chỉ Me2SiO3 tan trong nước nóng (được gọi là thủy tinh tan), khi tan bị thủy phân tạo dd kiềm yếu. Me2SiO3 + 2H2O ⇌ H2SiO3 + 2MeOH - Dung dịch Na2SiO3 đậm đặc được gọi là thủy tinh lỏng. Được dùng để chống cháy cho gỗ, vải; làm hồ dán thủy tinh, sứ.
- 60. Chương V nvhoa102@gmail.com 24 CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E) Vật liệu silicat: - Thủy tinh: công thức gần đúng Na2O.CaO.6SiO2; bị ăn mòn bởi dung dịch kiềm, F2, HF; bị thủy phân tạo dung dịch kiềm yếu: Na2O.CaO.6SiO2 + 8H2O ⇌ 2NaOH + Ca(OH)2 + 6H2SiO3 - Đồ gốm: gạch, ngói, gạch chịu lửa, sành, sứ, men. - Ximăng: gồm chủ yếu Ca3(AlO3)2, Ca3SiO5, Ca2SiO4
- 61. Chương V nvhoa102@gmail.com 25 CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E) 3 Các hợp chất của gecmani, thiếc, chì 3.1 Hợp chất oxi (EO) và hydroxit (E(OH)2) - Đều ít tan trong nước. - Có tính lưỡng tính, tính bazo tăng dần từ Ge Pb Sn(OH)2 + 3HCl đặc H[SnCl3] + 2H2O Sn(OH)2 + NaOH đặc Na[Sn(OH)3] PbO + 2HNO3 loãng Pb(NO3)2 + H2O PbO + 2NaOH đặc + H2O Na2[Pb(OH)4]
- 62. Chương V nvhoa102@gmail.com 26 CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E) - Có tính khử đặc trưng: 3Sn(OH)2 + 12NaOH đặc + 2Bi(NO3)3 3Na2[Sn(OH)6] + 2Bi + 6NaNO3 6PbO + O2 2(Pb2 II PbIV)O4 - Tính oxi hóa yếu: 2PbO + PbS 3Pb + SO2 SnO + H2 Sn + H2O
- 63. Chương V nvhoa102@gmail.com 27 CHƯƠNG V: CÁC NGUYÊN TỐ PHÂN NHÓM IVA (E) 3.2 Hợp chất oxi (EO2) - GeO2 ít tan trong nước; SnO2 và PbO2 không tan. - Có tính lưỡng tính, tan trong kiềm dễ hơn axit: EO2 + 2KOH + 2H2O K2[E(OH)6] - Chỉ PbO2 không bền nhiệt: - Tính oxi hóa đặc trưng, tăng dần GeO2 PbO2: 3PbO2 + 2Cr(OH)3 + 10KOH 2K2CrO4 + 3K2[Pb(OH)4] + 2H2O 2PbO2 + 2H2SO4 2PbSO4 + 2H2O + O2
- 64. Chương VI nvhoa102@gmail.com 1 CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 65. Chương VI nvhoa102@gmail.com 2 CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E) NỘI DUNG NHẬN XÉT CHUNG I. ĐƠN CHẤT II. HỢP CHẤT 1. Hợp chất của nitơ 2. Hợp chất của photpho III. PHÂN BÓN TÀI LIỆU [1] – Tập 2, Chương 6: trang 161 – 217 [2] – Chương 5: trang 105 – 141 [3] – Phần II, Chương 3: trang 179 – 273 [4] – Chapter 15: page 485 – 545
- 66. Chương VI nvhoa102@gmail.com 3 NHẬN XÉT CHUNG - Cấu hình electron hóa trị: ns2np3. E + 3e- = E3- thể hiện tính oxi hóa. E – ne- E(+1) đến E(+5) thể hiện tính khử. - Từ N Bi: Tính PK, tính oxihóa, tính axit của oxit, độ bền (+5) Tính KL, tính khử, tính bazo của oxit, độ bền (+3) Trừ N2, khả năng tạo mạch E – E từ P Bi. N2, P: phi kim – As, Sb: lưỡng kim – Bi là kim loại. CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 67. Chương VI nvhoa102@gmail.com 4 I ĐƠN CHẤT 1 Nitơ (χ = 3,04) Elk = 942 kJ/mol N2 trơ ở điều kiện thường. 1.1 Tính chất vật lý - Khí không màu, không mùi, không vị. - Ít tan trong nước và các dung môi hữu cơ. - Nhiệt độ nóng chảy và nhiệt độ sôi thấp. - Không duy trì sự cháy, sự sống. CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 68. Chương VI nvhoa102@gmail.com 5 1.2 Tính chất hóa học - Ở điều kiện thường chỉ tác dụng với Li: 6Li + N2 2Li3N - Ở nhiệt độ cao nitơ có tính oxi hóa và khử: Tính oxi hóa: N2 + 3H2 ⇌ 2NH3 (350 – 550 oC, 150 – 1000 at, -Fe.K2O/Al2O3) N2 + 3Mg Mg3N2 (8000C) Tính khử: N2 + 3F2 2NF3 (phóng điện) N2 + O2 ⇌ 2NO (20000C, Pt/MnO2) CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 69. Chương VI nvhoa102@gmail.com 6 1.3 Trạng thái tự nhiên, điều chế, ứng dụng • Trong không khí nitơ chiếm 78,03 %. • Các hợp chất chứa nitơ bao gồm khoáng diêm tiêu natri (NaNO3); các hợp chất hữu cơ phức tạp trong cơ thể động thực vật. Điều chế: Trong công nghiệp: Chưng cất phân đoạn KK lỏng Trong PTN: NH4NO2 N2 + 2H2O (nhiệt phân) NH4Cl + NaNO2 N2 + NaCl + 2H2O 2NaN3 3N2 + 2Na CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 70. Chương VI nvhoa102@gmail.com 7 2 Photpho (χ = 2,19) 2.1 Tính chất vật lý: Photpho có 3 dạng thù hình: Photpho trắng (P4): Không bền P đỏ; phát quang; độc; không tan trong nước; tan trong CS2, benzene. CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 71. Chương VI nvhoa102@gmail.com 8 Photpho đỏ - P∞: Bền; không độc; thăng hoa khi đun nóng; không tan trong CS2 CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 72. Chương VI nvhoa102@gmail.com 9 0 200 300 12000 C atm 0 250 C,khoâng coùKK P P Pñoû ñentraéng Photpho đen - P∞: Rất bền; không độc; bán dẫn (1,5 eV). 600 oC, P CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 73. Chương VI nvhoa102@gmail.com 10 2.2 Tính chất hóa học • Hoạt tính hóa học: Ptrắng > Pđỏ > Pđen P4 + 5O2 P4O10 ; 4Pđỏ + 5O2 P4O10 4Pđen + 5O2 P4O10 • Có tính khử (đặc trưng) và tính oxi hóa: 8P + 8O2 thiếu P4O6 + P4O10 ; 4P + 5O2 dư P4O10 2P + 8H2O 2H3PO4 + 5H2 P4 + 3NaOH + 3H2O PH3 + 3NaH2PO2 3P4 + 9Mg 4Mg3P3 40 oC 250 oC 400 oC 800 oC CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 74. Chương VI nvhoa102@gmail.com 11 2.3 Trạng thái tự nhiên, điều chế, ứng dụng Trạng thái tự nhiên: Khoáng photphorit: Ca3(PO4)2 Quặng apatit: Ca5X(PO4)3 (X = F-, OH- …) Phân chim, xương động vật. Điều chế trong CN: 2Ca3(PO4)2 + 10C + 6SiO2 3CaO.2SiO2 + 10CO + P4 Ứng dụng: diêm, axit photphoric … CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 75. Chương VI nvhoa102@gmail.com 12 II HỢP CHẤT 1 Các hợp chất của nitơ pH = 0: 1.1 Hợp chất N (-3): Nitrua Đốt nóng KL, PK (trừ O2, F2) với N2 nitrua Na3N Mg3N2 AlN Si3N4 P3N5 S4N4 Cl3N Li3N + 3H2O 3LiOH + NH3 Cl3N + 3H2O 3HClO + NH3 axitbaz lưỡng tính CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 76. Chương VI nvhoa102@gmail.com 13 Amoniac (NH3) Tính chất vật lý: • Chất khí, không màu, mùi khai, momen lưỡng cực = 1,48 D. • Tan nhiều trong nước. Dung dịch đậm đặc 25% NH3 có d = 0,91 g/mL. • Dễ bị nén. • Dung môi ion hóa tốt đối với nhiều chất NH3 + NH3 ⇌ NH4 + + NH2 - K -50oC = 2.10-33 CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 77. Chương VI nvhoa102@gmail.com 14 Tính chất hóa học: • Phản ứng cộng hợp (đặc trưng): NH3+ HCl NH4Cl 2NH3 + AgCl [Ag(NH3)2]Cl • Phản ứng khử khi đốt nóng: 4NH3 + 3O2 2N2 + 6H2O 4NH3 + 5O2 4NO + 6H2O 2NH3 + 3CuO 3Cu + 2H2O + N2 800 - 900 oC Pt/Rh CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 78. Chương VI nvhoa102@gmail.com 15 • Phản ứng thế ở nhiệt độ cao: Na + NH3 ½H2 + NaNH2 2Na + NH3 H2 + Na2NH 3Na + NH3 3/2H2 + Na3N • Bazo yếu: NH3 + H2O ⇌ NH4 + + OH ̅ Kb = 1,8.10-5 Điều chế NH3 PTN: NH4Clrắn + NaOHđậm đặc NaCl + NH3 + H2O CN: 1N2 + 3H2 ⇌ 2NH3 (350500 oC, 1501000 atm, xúc tác Fe,K2O/Al2O3) CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 79. Chương VI nvhoa102@gmail.com 16 Amoni (NH4 +) • Dễ tan trong nước, bị thủy phân. NH4 + + H2O ⇌ NH3 + H3O+ Ka = 5,6.10-10 • Dễ kết tinh: (NH4)2SO4.Al2(SO4)3 .24H2O; (NH4)2SO4.Fe2(SO4)3 .24H2O; (NH4)2SO4.FeSO4.6H2O • Dễ phân hủy nhiệt: [NH4HCO3; NH4Cl; NH4NO3] • Tính khử: 2NH4Cl + 4CuO 3Cu + CuCl2 + N2 + 4H2O • 2NH4Cl + ZnO ZnCl2 + 2NH3 + H2O R = 1,43 Å CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 80. Chương VI nvhoa102@gmail.com 17 1.2 Hợp chất N (+3): N2O3, HNO2, NO2 - N2O3 • Không bền: N2O3 ⇌ NO + NO2 • Anhydrit axit nitrơ, oxit axit: N2O3 + H2O ⇌ 2HNO2 N2O3 + 2NaOH 2NaNO2 + H2O HNO2 • Axit yếu (Ka = 4,5.10-4), không bền: 3HNO2 HNO3 + 2NO + H2O CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E) -100 oC
- 81. Chương VI nvhoa102@gmail.com 18 NO2 - • Đa phần dễ tan trong nước. • Bền hơn axit, tính bền nhiệt: Muối với Me: bền nhiệt. Muối với kim loại đứng trước Cu oxit kim loại: Cu(NO2)2 CuO + NO + NO2 Muối với kim loại đứng sau Cu kim loại: AgNO2 Ag + NO2 • Có khả năng tạo phức chất, vd: K3[Co(NO2)6] CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 82. Chương VI nvhoa102@gmail.com 19 N2O3, HNO2, NO2 - : có tính oxi hóa và khử • Tính oxi hóa: 2HNO2 + 2FeSO4 + H2SO4 Fe2(SO4)3 + 2NO + 2H2O 2NaNO2 + 2HI I2 + 2NO + 2NaOH • Tính khử: 5HNO2 + 2KMnO4 + 3H2SO4 5HNO3 + 2MnSO4 + K2SO4 + 3H2O 5NaNO2 + 2KMnO4 + 3H2SO4 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 83. Chương VI nvhoa102@gmail.com 20 1.3 Hợp chất N (+4): NO2 • Khí màu nâu đỏ, mùi khó chịu và độc. • Không bền nhiệt: 2NO2 2NO + O2 ; 2NO2 N2 + 2O2 • Anhydrit của hỗn hợp axit nitrơ và axit nitric: 2NO2 + H2O ⇌ HNO2 + HNO3 2NO2 + 2NaOH NaNO2 + NaNO3 + H2O 150 oC 600 oC CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 84. Chương VI nvhoa102@gmail.com 21 • Có tính oxi hóa và khử: Tính oxi hóa: 2NO2 + 7H2 2NH3 + 4H2O NO2 + 2Cu Cu2O + NO NO2 + CO CO2 + NO NO2 + SO2 SO3 + NO Tính khử: 2NO2 + O3 N2O5 + O2 2NO2 + H2O2 2HNO3 CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 85. Chương VI nvhoa102@gmail.com 22 1.4 Hợp chất N (+5): N2O5, HNO3, NO3 - N2O5 • Không bền: 2N2O5 4NO2 + O2 • Anhydrit axit nitric: N2O5 + H2O 2HNO3 HNO3 • Chất lỏng không màu, bốc khói mạnh trong không khí, tan vô hạn trong nước và tỏa nhiều nhiệt: HNO3 + nH2O HNO3.nH2O + Q (n = 1; 3) CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 86. Chương VI nvhoa102@gmail.com 23 • Không bền bởi ánh sáng và nhiệt: 4HNO3 4NO2 + O2 + 2H2O • Dung dịch loãng có tính axit tương đối mạnh: HNO3 + H2O ⇌ H3O+ + NO3 - Ka = 24 • Oxi hóa mạnh ở mọi nồng độ: 8HNO3 loãng + 3Cu 3Cu(NO3)2 + 2NO + 4H2O 10HNO3 đặc + 3I2 6HIO3 + 10NO + 2H2O 5HNO3 đặc + 3P + 2H2O 3H3PO4 + 5NO 2HNO3 + 6FeSO4 + 3H2SO4 3Fe2(SO4)3 + 2NO + 4H2O FeSO4 + NO [Fe(NO)]SO4 CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 87. Chương VI nvhoa102@gmail.com 24 • Hỗn hợp gồm 1V HNO3đặc và 3V HClđặc được gọi là nước cường toan (cường thủy), có tính oxi hóa rất mạnh do tạo thành clo nguyên tử: Au + HNO3 + 4HCl H[AuCl4] + NO + 2H2O 3Pt + 4HNO3 + 18HCl 3H2[PtCl6] + 4NO + 8H2O • HNO3 đặc nguội làm thụ động Fe, Al, Cr, Be … • Điều chế: - PTN: KNO3 + H2SO4 đặc KHSO4 + HNO3 - CN: 4NH3 + 5O2(kk) 4 NO + 6H2O (850 oC, Pt/Rh) 4NO + 2O2(kk) 4NO2 3NO2 + H2O 2HNO3 + NO CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 88. Chương VI nvhoa102@gmail.com 25 NO3 - • Dễ tan trong nước. • Bền hơn axit, nhưng không bền nhiệt, khi to: Muối với Me muối nitrit: KNO3 KNO2 + ½O2 Muối với kim loại đứng trước Cu oxit kim loại: Zn(NO2)2 ZnO + 2NO2 + ½O2 Muối với kim loại đứng sau Cu kim loại: AgNO3 Ag + NO2 + ½O2 CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 89. Chương VI nvhoa102@gmail.com 26 • Tính oxi hóa: NaNO3 + 4Zn + 7NaOH + 6H2O 4Na2[Zn(OH)4] + NH3 2NaNO3 + 3Cu + 4H2SO4 3CuSO4 + Na2SO4 + 2NO + 4H2O • Diêm tiêu kali (KNO3): KNO3 dùng làm phân bón, chất bảo quản, công nghiệp thủy tinh. NaNO3 + KCl ⇌ NaClkết tinh ~ 30oC + KNO3 kết tinh ~ 22oC CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 90. Chương VI nvhoa102@gmail.com 27 2 Các hợp chất của phopho 2.1 Hợp chất P (-3): Photphua Các đặc điểm tương tự như nitrua. Photphin – PH3 • Chất khí , mùi trứng thối, rất độc. • Tham gia phản ứng cộng hợp: PH3 + HI PH4I • Có tính khử mạnh: PH3 + 2O2 H3PO4 CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 91. Chương VI nvhoa102@gmail.com 28 2.2 Hợp chất P (+3): P4O6, H3PO3 Photpho (III) oxit – P4O6 • Không bền nhiệt: 4P4O6 3P4O8 + 4P(đỏ) • Anhydrit axit photphorơ: P4O6 + 6H2O 4H3PO3 • Chất khử mạnh: P4O6 + 2O2 P4O10 • Điều chế: P4 + 3O2 thiếu P4O6 440 oC 50 - 60 oC CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 92. Chương VI nvhoa102@gmail.com 29 Axit photphorơ – H3PO3 • Là axit trung bình, phân ly 2 nấc H+, đúng ra nên viết H2PHO3 H3PO3 + H2O ⇌ H3O+ + H2PO3 ̅ K1 = 10-2 H2PO3 ̅ + H2O ⇌ H3O+ + HPO3 2– K2 = 3.10-7 H3PO3 + 2NaOHđặc Na2HPO3 + 2H2O • Phân hủy nhiệt: 4H3PO3 3H3PO4 + PH3 • Là chất khử mạnh: 2H3PO3 + O2 2H3PO4 CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 93. Chương VI nvhoa102@gmail.com 30 2.3 Hợp chất P (+5) Photpho (V) oxit – P4O10 • P4O10 tác dụng với nước tạo nhiều loại axit photphoric: • Đơn giản có 3 loại axit sau: P2O5 + H2O 2HPO3 ; P2O5 + 2H2O H4P2O7 P2O5 + 3H2O 2H3PO4 CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 94. Chương VI nvhoa102@gmail.com 31 Axit photphoric – H3PO4 • Là axit 3 lần, có độ mạnh trung bình: H3PO4 + H2O ⇌ H3O+ + H2PO4 ̅ K1 = 7,52.10-3 H2PO4 ̅ + H2O ⇌ H3O+ + HPO4 2– K2 = 6,31.10-8 HPO4 2– + H2O ⇌ H3O+ + PO4 3– K3 = 2,2.10-13 • Axit bị nhiệt phân mất nước dần: H3PO4 H4P2O7 HPO3 • Rất bền, chỉ thể hiện tính oxi hóa yếu ở to > 400 oC. t0 t0 CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 95. Chương VI nvhoa102@gmail.com 32 Muối photphat • Muối photphat rất đa dạng, có tính tan khác nhau: H2PO4 ̅ tan trong nước, các photphat còn lại đa số không tan. • Các muối photphat bị nhiệt phân khử nước như sau: NaH2PO4 → Na2H2P2O7 → (NaPO3)x → (NaPO3)3 → (NaPO3)6 Viết đơn giản: Na2HPO4 Na4P2O7 ; NaH2PO4 NaPO3 CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 96. Chương VI nvhoa102@gmail.com 33 III PHÂN BÓN 1 Phân đạm: (NH4)2SO4 – SA (đạm 1 lá) NH4NO3 – NA (đạm 2 lá) (NH2)2CO – Urê NH4Cl 2 Phân lân – Ca(H2PO4)2 Super photphat đơn Super photphat kép CHƯƠNG VI: CÁC NGUYÊN TỐ PHÂN NHÓM VA (E)
- 97. Chương VII nvhoa102@gmail.com 1 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X)
- 98. Chương VII nvhoa102@gmail.com 2 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) NỘI DUNG NHẬN XÉT CHUNG I. ĐƠN CHẤT 1. Oxi 2. Lưu huỳnh II. HỢP CHẤT 1. Hợp chất của oxi 2. Hợp chất của lưu huỳnh TÀI LIỆU [1] – Tập 2, Chương 7: trang 218 – 250 [2] – Chương 4: trang 61 – 104 [3] – Phần II, Chương 4: trang 274 – 330 [4] – Chapter 16: page 546 – 590
- 99. Chương VII nvhoa102@gmail.com 3 NHẬN XÉT CHUNG - Cấu hình electron hóa trị: ns2np4 X + 2e- = X2- (liên kết ion hoặc CHT), thể hiện tính oxi hóa. - Tính phi kim, tính oxi hóa giảm từ O2 đến Po. - Từ S trở đi, có khả năng nhường e thể hiện tính khử. - Từ S trở đi, do có ON d còn trống tạo nhiều số oxi hóa dương (+2, +4, +6). - Các H2X có tính bền nên tính khử, tính axit . CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X)
- 100. Chương VII nvhoa102@gmail.com 4 I ĐƠN CHẤT 1 Oxi (χ = 3,44) Có hai thù hình: dioxi (O2) – oxi và trioxi (O3) – ozôn 1.1 Oxi - Khí không màu, không mùi, không vị. - Ít tan trong nước, tan nhiều hơn trong các dung môi hữu cơ. - Nhiệt độ nóng chảy và nhiệt độ sôi thấp. - Duy trì sự cháy, cần cho sự sống. CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X)
- 101. Chương VII nvhoa102@gmail.com 5 - Bậc liên kết bằng 2, năng lượng liên kết lớn (494 kJ/mol) O2 khá bền, không phân cực. - Là chất oxi hóa mạnh: O2 + 2H2 2H2O (nổ) O2 + 2NO 2NO2 (tức thì) 2Fe + 3/2O2 + nH2O Fe2O3.nH2O (rất chậm) (gỉ sắt) - Sự tạo thành O2 trong tự nhiên: 6CO2 + 6H2O C6H12O6 + 6O2 Diệp lục Ánh sáng CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X)
- 102. Chương VII nvhoa102@gmail.com 6 - Điều chế: Trong PTN: Nhiệt phân các hợp chất giầu oxi: KClO3 KCl + O2 2KNO3 2KNO2 + O2 2KMnO4 K2MnO4 + MnO2 + O2 Trong công nghiệp: • Chưng cất phân đoạn không khí lỏng. • Điện phân dung dịch kiềm. • Rây phân tử. to, MnO2 to to CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X)
- 103. Chương VII nvhoa102@gmail.com 7 1.2 Ozôn Bậc liên kết bằng 1,5. Momen lưỡng cực = 0,52 D So với oxi, ozôn có: - to nc và to s thấp nhưng cao hơn. - Tan trong nước nhiều hơn. - Kém bền hơn: O3 O2 + O - Hoạt tính hóa học mạnh hơn: 2Ag + O3 Ag2O + O2 2KI + O3 + H2O I2 + 2KOH + O2 * CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X)
- 104. Chương VII nvhoa102@gmail.com 8 Sự tạo thành O3: Điều chế: Phóng điện êm qua O2 ở 30.000 V hay tác dụng các bức xạ sóng ngắn lên oxi: 3O2 2O3 Trong tự nhiên: O2 2O (tia tử ngoại = 160 – 240 nm ) O + O2 O3 O3 O + O2 (tia tử ngoại = 240 – 360 nm) (Vành đai bảo vệ trái đất) hυ hυ 2 3O + O O 160 – 240 nm 240 – 360 nm CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X)
- 105. Chương VII nvhoa102@gmail.com 9 The electromagnetic spectrum CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X)
- 106. Chương VII nvhoa102@gmail.com 10 Hiện tượng suy giảm tầng ozôn: Nguyên nhân: Freon (CFCl3, CF2Cl2, CHClF2); NOx: CF2Cl2 CF2Cl + Cl ( = 190 – 225 nm) Cl + O3 ClO + O2 ClO + O Cl + O2 O3 + O 2O2 hυ CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X)
- 107. Chương VII nvhoa102@gmail.com 11
- 108. > 95,60C < 95,60C S ⇌ S Chương VII nvhoa102@gmail.com 12 2 Lưu huỳnh (χ = 2,58) 2.1 Tính chất vật lý - Có nhiều dạng thù hình: • to phòng – S8: Tà phương (S ) và đơn tà (S ) • ∼ 200 oC – S • ∼ 450 oC – S6 • ∼ 650 oC – S4 • ∼ 900 oC – S2 • > 1500 oC – S CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X)
- 109. Chương VII nvhoa102@gmail.com 13 - Quá trình nấu chảy S: S , S 112,8 oC hay 119,3 oC S8 lỏng, vàng >160 oC Lỏng, nâu, nhớt 160oC – 200oC Nhựa dẻo, nâu đen >200 oC Độ nhớt 444,6 oC Hơi, vàng da cam, S6 S4 650 oC S2 ∼900 oC S >1500 oC CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X)
- 110. Chương VII nvhoa102@gmail.com 14 - Lưu huỳnh dòn, cách điện, không tan trong nước, tan trong benzene, dầu hỏa, CS2. 2.2 Tính chất hóa học: S là phi kim điển hình, thể hiện tính oxi hóa và khử: Tính oxi hóa: Slỏng + H2 ⇌ H2S ; S + Fe FeS Tính khử: S + O2 SO2 S + 2H2SO4 đặc nóng 3SO2 + 2H2O ~3000C >3000C to CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X)
- 111. Chương VII nvhoa102@gmail.com 15 2.3 Trạng thái tự nhiên, điều chế, ứng dụng Trạng thái tự nhiên: • Đơn chất. • Hợp chất: dạng sunfua (FeS2, FeCuS2 …), dạng sunfat (CaSO4.2H2O, BaSO4 …) … S đơn chất Quặng pyrit Khoáng baritin CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X)
- 112. Chương VII nvhoa102@gmail.com 16 Điều chế: FeS2 FeS + S Ứng dụng: • Sản xuất H2SO4 • Lưu hóa cao su • Sản xuất CS2 • Sản xuất thuốc trừ sâu. Compressed air under a pressure of 20-25 atmosphere Super heated water at 1700C > 600 oC CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X)
- 113. Chương VII nvhoa102@gmail.com 17 II HỢP CHẤT 1 Hợp chất của oxi • Oxit – O2- • Peoxit – (O2)2- có cấu tạo cầu – O – O – • Superoxit – (O2)- • Ozonit – (O3)- • Các hợp chất có số oxi hóa dương: (O2)2+; O2+ - Hợp chất peoxit quan trọng là H2O2 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X)
- 114. Chương VII nvhoa102@gmail.com 18 H2O2 (hydro peoxit, oxi già): - Chất lỏng, không màu, tan vô hạn trong nước. - Không bền (gây nổ) bởi nhiệt độ, ánh sáng, xúc tác (MnO2, Ag …): H2O2 H2O + O - Tính axit yếu: H2O2 + H2O ⇌ H3O+ + HO2 - K = 2,4.10-12 H2O2 + 2NaOH Na2O2 + 2H2O H2O2 + Ba(OH)2 BaO2 + 2H2O H2O2 pha hơi H2O2 pha rắn CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X)
- 115. Chương VII nvhoa102@gmail.com 19 - Tính oxi hóa (đặc trưng): H2O2 + 2H+ + 2e ⇌ 2H2O, 0 = +1,78 V 4H2O2 + PbS PbSO4 + 4H2O H2O2 + 2KI 2KOH + I2 - Tính khử: H2O2 - 2e ⇌ O2 + 2H+ , 0 = +0,68 V 5H2O2 + 2KMnO4 + 3H2SO4 2MnSO4 + 5O2 + K2SO4 + 8H2O * CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X)
- 116. Chương VII nvhoa102@gmail.com 20 - Điều chế: • Trong PTN: BaO2 + H2SO4 H2O2 + BaSO4 • Trong CN: Điện phân dung dịch H2SO4 50%: 2HSO4 ̅ 2e H2S2O8 H2S2O8 + 2H2O 2H2SO4 + H2O2 Phương pháp anky antroquinol: Pd or Ni CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X)
- 117. Chương VII nvhoa102@gmail.com 21 2 Hợp chất của lưu huỳnh 2.1 Hợp chất S (-2) Dihydro sunfua (H2S): - Khí, không màu, mùi trứng thối, rất độc, ít tan trong nước ( = 1,02 D), tan nhiều hơn trong các dung môi hữu cơ. - Trong dung dịch nước, có tính axit yếu: H2S + H2O ⇌ H3O+ + HS- K1 = 10-7 HS- + H2O ⇌ H3O+ + S2 K2 = 10-19 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X)
- 118. Chương VII nvhoa102@gmail.com 22 - Có tính khử mạnh: 2H2S + O2 2S↓ + 2H2O * (thiếu O2, to thấp) 2H2S + 3O2 2SO2 + 2H2O (dư oxy, to) H2S + 2O2 H2SO4 (dư O2, to,xt, hơi ẩm) H2S + 2FeCl3 S↓ + 2FeCl2 + 2HCl 5H2S + 2KMnO4 + 3H2SO4 5S +2MnSO4 + K2SO4 + 8H2O H2S + 3H2SO4(đặc, nóng) 4SO2 + 4H2O H2S + 4Br2 + 4H2O H2SO4 + 8HBr CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X)
- 119. Chương VII nvhoa102@gmail.com 23 Muối sunfua: - Phân loại muối sunfua theo độ tan: • Sunfua tan trong nước: Na2S, BaS, Al2S3, Cr2S3 … • Suafua tan trong axit loãng: MnS, FeS, ZnS … • Sunfua tan trong axit có tính oxi hóa mạnh: CuS, Ag2S, HgS, PbS … - Muối sunfua có tính khử mạnh: 2ZnS + 3O2 2ZnO + 2SO2 3S2 + 8NO3 ̅ + 8H+ 3SO4 2– + 8NO + 4H2O CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X)
- 120. Chương VII nvhoa102@gmail.com 24 - Muối sunfua axit, bazo, lưỡng tính: SiS2 + 3H2O ⇌ H2SiO3 + 2H2S Na2S + H2O ⇌ NaHS + NaOH Cr2S3 + 6H2O ⇌ 2Cr(OH)3 + 3H2S 2.2 Hợp chất S(+4): SO2, H2SO3, SO3 2- SO2 - Anhydrit sunfurơ: SO2 + H2O ⇌ H2SO3 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X)
- 121. Chương VII nvhoa102@gmail.com 25 - Oxit axit: SO2 + 2NaOH Na2SO3 + H2O H2SO3 (SO2.xH2O) - Không bền, có tính axit trung bình với Ka1=2.10-2, Ka2=6.10-6. HSO3 - , SO3 2- - Chúng không bền nhiệt; SO3 2- bền hơn HSO3 -. - Chỉ MeHSO3 và M(HSO3)2 dễ tan và bị thủy phân tạo môi trường axit yếu. - Chỉ Me2SO3 tan và bị thủy phân tạo môi trường kiềm yếu. CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X)
- 122. Chương VII nvhoa102@gmail.com 26 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) SO2, HSO3 - và SO3 2- có tính oxi hóa yếu và khử mạnh: - Oxi hóa yếu: SO2 + 2CO S + 2CO2 * Na2SO3 + 2Na2S + 7H2SO4 4S + 6Na2SO4 + 7H2O - Khử đặc trưng: 2SO2 + O2 2SO3 (to,V2O5) 2Na2SO3 + O2kk 2Na2SO4 Điều chế SO2 trong PTN: NaHSO3 + H2SO4đ NaHSO4 + SO2 + H2O
- 123. Chương VII nvhoa102@gmail.com 27 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) 2.3 Hợp chất S(+6): SO3, H2SO4, SO4 2- SO3 - Anhydrit sunfuric: SO3 + H2O H2SO4 Ho = - 89,12 kJ - Oxi axit: SO3 + 2NaOH Na2SO4 + H2O H2SO4 - Chất lỏng, sánh như dầu, tan vô hạn trong nước và tỏa nhiều nhiệt. - Là dung môi ion hóa mạnh: H2SO4 + H2SO4 ⇌ H3SO4 + + HSO4 -
- 124. Chương VII nvhoa102@gmail.com 28 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) - H2SO4 tinh khiết không điện ly. - Dung dịch loãng H2SO4 điện ly 2 nấc H+: H2SO4 + H2O ⇌ H3O+ + HSO4 - Ka1 = 103 HSO4 - + H2O ⇌ H3O+ + SO4 2- Ka2 = 10-2 - Dung dịch đậm đặc nóng có tính oxi hóa mạnh: 2H2SO4 đ + 2Ag → Ag2SO4 + SO2 + 2H2O 2H2SO4 đ + C → CO2 + 2SO2 + 2H2O H2SO4 đ + 2HBr → SO2 + Br2 + 2H2O - Dung dịch đậm đặc nguội làm thụ động Fe,Al,Cr … to to to
- 125. Chương VII nvhoa102@gmail.com 29 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) Điều chế H2SO4 trong công nghiệp: Chế tạo SO2: S + O2 → SO2 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 Chuyển hóa SO2 thành SO3: 2SO2 + O2 ⇌ 2SO3 Hấp thu SO3 trong H2SO4 98,3%: SO3 + H2SO4 98,3% → các polisunfuric (oleum) 400 - 550 oC V2O5,Me2O/SiO2 to to
- 126. Chương VII nvhoa102@gmail.com 30 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) 2.4 Các axit và muối khác của S H2S2O3 và S2O3 2-: - Axit thiosunfuric không bền: H2S2O3 → S + SO2 + H2O Na2S2O3 + H2SO4 → Na2SO4 + SO2 + S + H2O Là axit trung bình mạnh, điện ly 2 nấc H+ với Ka1 = 0,25; Ka2 = 1,8.10-2. Có tính khử đặc trưng: 2H2S2O3 + I2 → H2S4O6 + 2HI 0 +4
- 127. Chương VII nvhoa102@gmail.com 31 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) - Muối thiosunfat (Na2S2O3.5H2O) bền, có tính khử và tạo phức: Na2S2O3 + 4Cl2 + 5H2O → 2NaHSO4 + 8HCl (1) 2Na2S2O3 + I2 → 2NaI + Na2S4O6 (2) 2Na2S2O3 + AgBr → Na3[Ag(S2O3)2] + NaBr (3) Điều chế: Na2SO3 + S → Na2S2O3 (dd bão hòa) Natri tetrathionat to
- 128. Chương VII nvhoa102@gmail.com 32 CHƯƠNG VII: CÁC NGUYÊN TỐ PHÂN NHÓM VIA (X) H2S2O8 và S2O8 2-: - Axit pesunfuric không bền trong nước: H2S2O8 + 2H2O → 2H2SO4 + H2O2 - Muối pesunfat có tính oxi hóa mạnh: 2MnSO4 + 5(NH4)2S2O8 + 8H2O → 2HMnO4 + 5(NH4)2SO4 + 7H2SO4
- 129. Chương VIII nvhoa102@gmail.com 1 CHƯƠNG VIII: CÁC NGUYÊN TỐ PHÂN NHÓM VIIA (X)
- 130. Chương VIII nvhoa102@gmail.com 2 CHƯƠNG VIII: CÁC NGUYÊN TỐ PHÂN NHÓM VIIA (X) NỘI DUNG NHẬN XÉT CHUNG I. ĐƠN CHẤT II. HỢP CHẤT 1. Các hợp chất X (-1) 2. Các hợp chất có số oxi hóa dương TÀI LIỆU [1] – Tập 2, Chương 8: trang 251 – 277 [2] – Chương 3: trang 34 – 60 [3] – Phần II, Chương 5: trang 331 – 365 [4] – Chapter 17: page 591 – 623
- 131. Chương VIII nvhoa102@gmail.com 3 NHẬN XÉT CHUNG - Cấu hình electron hóa trị: ns2np5 X + 1e- = X- (liên kết ion hoặc CHT), thể hiện tính oxi hóa mãnh liệt. - Từ F2 đến I2 tính phi kim, tính oxi hóa giảm. - Từ Cl2 trở đi, tạo các hợp chất số oxi hóa dương từ +1 đến +7. Chúng kém bền, có tính oxi hóa mạnh. - I2 tạo được các ion +1 (vd: ICl, ICN, IClO4); +3 (vd: IPO4, I(CH3COO)3). CHƯƠNG VIII: CÁC NGUYÊN TỐ PHÂN NHÓM VIIA (X)
- 132. Chương VIII nvhoa102@gmail.com 4 I ĐƠN CHẤT 1 Lý tính - Điều kiện thường tồn tại ở dạng phân tử X2. - Có mùi xốc, khó chịu, rất độc. - Có nhiệt độ nóng chảy, nhiệt độ sôi thấp và tăng dần từ F2 I2. Riêng I2 bị thăng hoa. - Halogen tan ít trong nước, và tan nhiều trong dung môi hữu cơ (rượu, ete, benzen, CS2, CCl4 …) - Năng lượng liên kết X-X giảm dần từ Cl2 I2: F2 (4500C), Cl2 (8000C); Br2 (6000C); I2 (4000C) CHƯƠNG VIII: CÁC NGUYÊN TỐ PHÂN NHÓM VIIA (X)
- 133. Chương VIII nvhoa102@gmail.com 5 2 Hóa tính - Là những phi kim điển hình, có tính oxihóa mạnh. - Với cùng một nguyên tố phản ứng của halogen xảy ra theo mức độ giảm dần từ F2 I2. Với H2: X2 + H2 2HX Với H2O: F2 + H2O 2HF + O X2 + H2O ⇌ HXO + HX (K = 3.10-4; 4.10-9; 5.10-23) CHƯƠNG VIII: CÁC NGUYÊN TỐ PHÂN NHÓM VIIA (X)
- 134. Chương VIII nvhoa102@gmail.com 6 Phản ứng đẩy: F2 + 2NaCl 2NaF + Cl2 Cl2 + 2NaBr 2NaCl + Br2 Br2 + 2NaI 2NaBr + I2 3 Điều chế Nguyên tắc: Oxi hóa muối X- bằng chất oxihóa mạnh hay điện phân. F2: điện phân nóng chảy hỗn hợp KF + 3HF CHƯƠNG VIII: CÁC NGUYÊN TỐ PHÂN NHÓM VIIA (X)
- 135. Chương VIII nvhoa102@gmail.com 7 Cl2: - CN: điện phân NaCl nóng chảy hoặc dung dịch có màng ngăn. 2NaCl + 2H2O Cl2 + H2 + NaOH - PTN: oxi hóa HCl bằng KMnO4, MnO2, KClO3 MnO2 + 4HCl MnCl2 + Cl2 + 2H2O Br2, I2: - CN: Cl2 + 2X- X2 + 2Cl- - PTN: 2NaX + MnO2 + 2H2SO4 X2 + MnSO4 + Na2SO4 + 2H2O CHƯƠNG VIII: CÁC NGUYÊN TỐ PHÂN NHÓM VIIA (X)
- 136. Chương VIII nvhoa102@gmail.com 8 II HỢP CHẤT 1 Các hợp chất X (-1): HX, X- - Lý tính: • Liên kết H-X bền nhưng giảm dần từ HF HI. • Nhiệt độ nóng chảy, nhiệt độ sôi tăng dần từ HCl HI. • HX tan nhiều trong nước, đặc biệt HCl đặc bốc khói mạnh ngoài không khí. CHƯƠNG VIII: CÁC NGUYÊN TỐ PHÂN NHÓM VIIA (X)
- 137. Chương VIII nvhoa102@gmail.com 9 - Hóa tính: • Tính axit tăng từ HF HI HX + H2O ⇌ H3O+ + X- Riêng HF: ăn mòn thủy tinh HF lỏng là dung môi ion hóa mạnh: HNO3 + HF H2NO3 + + F- Axit, 0,1N HF HCl HBr HI , % 9 92,6 93,5 95 Ka 6,6.10-4 1,3.106 1,0.109 3,2.109 CHƯƠNG VIII: CÁC NGUYÊN TỐ PHÂN NHÓM VIIA (X)
- 138. Chương VIII nvhoa102@gmail.com 10 • Tính khử tăng từ HF HI, F- I-: HF, F-: Không thể hiện tính khử HCl, Cl-: Có tính khử yếu 2KMnO4 + 16HCl 2KCl + 2MnCl2 + 5Cl2 + 8H2O HBr, Br-: Có tính khử trung bình 2HBr + H2SO4,đặc Br2 + SO2 + 2H2O HI, I-: Có tính khử mạnh 8HI + H2SO4,đặc 4I2 + H2S + 4H2O HI + FeCl3 FeCl2 + I2 + HCl CHƯƠNG VIII: CÁC NGUYÊN TỐ PHÂN NHÓM VIIA (X)
- 139. Chương VIII nvhoa102@gmail.com 11 - Điều chế HX: HF: CaF2 + H2SO4 CaSO4 + 2HF HCl: tổng hợp trực tiếp từ H2 và Cl2 (trong CN) hay dùng axit mạnh đẩy (trong PTN): NaCl + H2SO4 NaHSO4 + HCl 2NaCl + NaHSO4 Na2SO4 + 2HCl HBr: PBr3 + 3H2O H3PO3 + 3HBr 2P + 3Br2 + 6H2O 2H3PO3 + 6HBr HI: PI3 + 3H2O H3PO3 + 3HI H2S + I2 S + 2HI CHƯƠNG VIII: CÁC NGUYÊN TỐ PHÂN NHÓM VIIA (X)
- 140. Chương VIII nvhoa102@gmail.com 12 2 Các hợp chất có số oxi hóa dương Gồm có : +1, +2, +3, +4, +5, + 6, +7 Các hợp chất halogen (+1): HClO, ClO-.... Các hợp chất halogen (+3): HClO2 , ClO2 -.... Các hợp chất halogen (+5): HClO3 , ClO3 -.... Các hợp chất halogen (+7): HClO4 , ClO4 -.... pH = 0 CHƯƠNG VIII: CÁC NGUYÊN TỐ PHÂN NHÓM VIIA (X)
- 141. Chương VIII nvhoa102@gmail.com 13 Axit HClO HClO2 HClO3 HClO4 Tính axit Ka = 4.10-8 Ka = 10-2 Ka 101 Ka 1010 Tính bền Vô cùng kém bền Rất kém bền Cmax = 40% HClO4.H2O Tính oxi hóa Rất mạnh Rất mạnh Mạnh kiểu HNO3 + 3HClđặc Kém hơn HClO3 Muối NaClO+NaCl Ca(ClO)2+CaCl2 KClO3 HClO HClO4: Tính axit tăng dần; Tính bền tăng dần; Tính oxi hóa giảm dần. CHƯƠNG VIII: CÁC NGUYÊN TỐ PHÂN NHÓM VIIA (X)
- 142. Chương VIII nvhoa102@gmail.com 14 Điều chế - ứng dụng: - Nước javen: NaClO – NaCl - Clorua vôi: (Ca(ClO)2 – CaCl2) hoặc CaOCl2 - Muối bectôle: KClO3 CHƯƠNG VIII: CÁC NGUYÊN TỐ PHÂN NHÓM VIIA (X)
- 143. Chương IX nvhoa102@gmail.com 1 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP
- 144. Chương IX nvhoa102@gmail.com 2 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP NỘI DUNG I. ĐẶC ĐIỂM CÁC NGUYÊN TỐ CHUYỂN TIẾP 1. Đặc điểm cấu tạo 2. Đặc tính chung II. PHỨC CHẤT 1. Khái niệm chung 2. Lý thuyết tạo phức TÀI LIỆU [1] – Tập 3, Chương 1: trang 3 – 46 [2] – Chương 10: trang 211 – 232 [4] – Chapter 20: page 665 – 715
- 145. Chương IX nvhoa102@gmail.com 3 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP I ĐẶC ĐIỂM CÁC NGUYÊN TỐT CHUYỂN TIẾP 1 Đặc điểm cấu tạo Các nguyên tố chuyển tiếp là các nguyên tố d (có e- cuối cùng sắp xếp vào AO (n-1)d) Cấu hình electron hóa trị của nguyên tố d: Nhóm III IV V VI Cấu hình e (n1)d1ns2 (n1)d2ns2 (n1)d3ns2 (n1)d5ns1 Nhóm VII VIII I II Cấuhình e (n1)d5ns2 (n1)d6,7,8ns2 (n1)d10ns1 (n1)d10ns2
- 146. Chương IX nvhoa102@gmail.com 4 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP - Số e hóa trị = số e phân lớp s lớp ngoài cùng + số e phân lớp d lớp kề lớp ngoài cùng = STT của nhóm. - Có 1 số ngoại lệ trong cấu trúc e ở PN VIB, IB, IIB và PN VIIIB. 2 Đặc tính chung - Chỉ có khả năng cho e Chúng là kim loại. - Có nhiều trạng thái oxihóa dương khác nhau và cách nhau 1 đơn vị: từ +1 đến STT nhóm.
- 147. Chương IX nvhoa102@gmail.com 5 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP - Số oxihóa dương cực đại = STT của nhóm (Ngoại lệ: Au, Cu). - Hợp chất có trạng thái oxi hóa dương thấp ( 3): kim loại - Hợp chất có trạng thái oxihóa dương cao ( 4): phi kim - Nguyên tố d dễ tạo thành các phức chất
- 148. Chương IX nvhoa102@gmail.com 6 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP II PHỨC CHẤT 1 Khái niệm chung Các phân tử, ion có thể kết hợp với nhau tạo PC: CoCl3 + 6NH3 = [Co(NH3)6]Cl3 Fe2+ + 6CN ̅ = [Fe(CN)6]4 BF3 + F- = [BF4]- Định nghĩa phức chất (ở trạng thái rắn và dung dịch): Phức chất là hợp chất ở nút mạng tinh thể có chứa các ion phức tích điện dương hay âm (ion phức) có khả năng tồn tại độc lập trong dung dịch.
- 149. Chương IX nvhoa102@gmail.com 7 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Cấu trúc tinh thể lập phương của phức [Mn(NH3)6]Cl2 → N → Cl- → Mn2+ Cấu trúc tinh thể NaCl
- 150. Chương IX nvhoa102@gmail.com 8 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Thành phần phức chất: Phức chất Cầu ngoại Cầu nội [M (L)n]đt Chất tạo phức Phối tử Số PT Điện tích PC = Đt (M) + n. Đt (L) Ví dụ: [Co(NH3)6]Cl3; [Fe(H2O)6]Cl2
- 151. Chương IX nvhoa102@gmail.com 9 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Liên kết trong phức chất: Do tương tác tĩnh điện hoặc cho – nhận hoặc gồm cả 2 tương tác trên giữa nguyên tử trung tâm (M) và phối tử (L). Phân loại PC: Cation: [Co(H2O)6]3+ Anion: [Al(OH)4]- Trung hòa: [Fe(CO)5]; [Co(NH3)3Cl3] Gọi tên PC : cation + anion phức hay cation phức + anion
- 152. Chương IX nvhoa102@gmail.com 10 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Tên của ion phức: Số phối tử + tên phối tử + tên chất tạo phức + (số oxh) Phức cation: gọi tên thường Phức anion: gọi tên Latinh + at Phối tử là anion: tên anion + o F-: floro Cl-: Cloro OH-: hidroxo PT trung hòa: H2O: aquơ ; CO: cacbonyl NO: nitrozyl NH3: ammin 1: mono 2: di 3: tri 4: tetra 5: penta 6: hexa (I), (II)
- 153. Chương IX nvhoa102@gmail.com 11 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Tên latinh của một số kim loại trong anion muối phức: Be – berilat B – borat Al – aluminat Sn – stanat Pb – plombat Sb - stibat Cu – cuprat Ag – acgentat Au – aurat Zn – zincat Hg – mecurat Cr - cromat Fe – ferat Co – cobantat Ni – nikelat Rh – rodat Pd – paladat Pt - platinat
- 154. Chương IX nvhoa102@gmail.com 12 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Sự phân li của phức chất trong dung dịch: K4[Fe(CN)6] 4K+ + [Fe(CN)6]4 [Fe(CN)6]4 ⇌ Fe2+ + 6CN ̅ Kkb càng lớn phức càng kém bền; Kb càng lớn phức càng bền sự cạnh tranh tạo phức. 2 6 ' 4 6 [ ][ ] 1 ( ) [ ( ) ] ( ) kb b Fe CN K Fe CN K
- 155. Chương IX nvhoa102@gmail.com 13 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Hằng số bền từng nấc và hằng số bền tổng Ni2+ + NH3 ⇌ [Ni(NH3)]2+ [Ni(NH3)]2+ + NH3 ⇌ [Ni(NH3)2]2+ [Ni(NH3)2]2+ + NH3 ⇌ [Ni(NH3)3]2+ [Ni(NH3)3]2+ + NH3 ⇌ [Ni(NH3)4]2+ [Ni(NH3)4]2+ + NH3 ⇌ [Ni(NH3)5]2+ [Ni(NH3)5]2+ + NH3 ⇌ [Ni(NH3)6]2+ Kb = Kb1 . Kb2 . Kb3 . Kb4 . Kb5 . Kb6 2 23 1 2 3 2 23 2 2 2 3 3 2 13 3 3 2 3 2 3 2 13 4 4 2 3 3 3 2 3 5 5 2 3 4 3 [ ( ) ] 4,68.10 [ ] .[ ] [ ( ) ] 1,32.10 [ ( ) ].[ ] [ ( ) ] 7,07.10 [ ( ) ].[ ] [ ( ) ] 1,18.10 [ ( ) ].[ ] [ ( ) ] 4 [ ( ) ].[ ] b b b b b Ni NH K Ni NH Ni NH K Ni NH NH Ni NH K Ni NH NH Ni NH K Ni NH NH Ni NH K Ni NH NH 2 3 6 6 2 3 5 3 ,26 [ ( ) ] 0,81 [ ( ) ].[ ] b Ni NH K Ni NH NH
- 156. Chương IX nvhoa102@gmail.com 14 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Ảnh hưởng của phản ứng tạo phức đến thế điện cực Fe2+ - e ⇌ Fe3+ (1) Khi có mặt F-: Fe3++6F- ⇌ [FeF6]3- (2) Fe2+ + 6F- - e ⇌ [FeF6]3- 3 166 3 6 [ ] 10 [ ].[ ] FeF Fe F 3 2 0 / ( 0,77 )Fe Fe V 3 0' 6 2 6 [ ] 0,059lg [ ].[ ] FeF Fe F 3 6 2 6 [ ] 1 (3) [ ].[ ] FeF Fe F = 0’ khi: (3) : (2) ⇒ 3 2 16 [ ] 1 [ ] 10 Fe Fe 3 2 3 2 3 0 2/ / [ ] 0,059lg 0,17 [ ]Fe Fe Fe Fe Fe V Fe
- 157. Chương IX nvhoa102@gmail.com 15 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Cơ sở: tương tác cho – nhận Cặp e hóa trị tự do của L AO hóa trị tự do của M [CoF6]3- : phức bát diện, thuận từ Co3+ : 3d64s 4p4d Phức bát diện lai hóa sp3d2 3d 4d4p4s .. .. .. .. .. .. F- F- F- F- F- F- Co: 3d74s2 Phức spin cao (phức obital ngoại) 2 Lý thuyết tạo phức 2.1 Thuyết liên kết hóa trị VB
- 158. Chương IX nvhoa102@gmail.com 16 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Số phối trí Hình dạng phức chất Obitan lai hoá của M Lai hoá Ví dụ 2 Đường thẳng s, pz sp [Ag(NH3)2]+ 3 Tam giác phẳng s, px, py sp2 [HgI3]- 4 Tứ diện s, px, py, pz sp3 [FeBr4]2- 4 Vuông phẳng s, px, py, dx2-y2 dsp2 [Ni(CN)4]2- 5 Tháp tam giác kép s, px, py, pz, dz2 sp3d [CuCl5]3- 5 Tháp hình vuông s, px, py, pz, dx2-y2 dsp3 [Ni(CN)5]3- 6 Bát diện s, px, py, pz, dz2, dx2-y2 sp3d2 [Co(NH3)6]3+ 6 Lăng trụ tam giác s, dxy, dxz, dyz, dz2, dx2-y2 Hoặc s, px, py, pz, dxy, dxz d5s Hoặc d2sp3 [ZrMe6]2-
- 159. Chương IX nvhoa102@gmail.com 17 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Số phối trí Hình dạng phức chất Obitan lai hoá của M Lai hoá Ví dụ 7 Tháp ngũ diện kép s, px, py, pz, dxy, dx2-y2, dz2 d3sp3 [V(CN)7]4- 7 Lăng trụ tam giác đơn chóp s, px, py, pz, dxy, dxz, dz2 sp3d3 [NbF7]2- 8 Lập phương s, px, py, pz, dxy, dxz, dyz, fxyz fsp3d3 [PaF8]3- 8 Đối lăng trụ hình vuông (Square antiprismatic) s, px, py, pz, dz2, dxy, dxz, dyz d4sp3 [Mo(CN)8]4- 8 12 mặt tam giác s, px, py, pz, dxy, dxz, dyz, dx2-y2 sp3d4 [TaF8]3- 9 Lăng trụ tam giác tam chóp s, px, py, pz, dxy, dxz, dyz, dz2, dx2-y2 sp3d5 [ReH9]2-
- 160. Chương IX nvhoa102@gmail.com 18 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP [Ag(NH3)2]+ [Cu(CN)3]2-Tam giác phẳng (sp2) Đường thẳng (sp) Hình dạng phức Ví dụ
- 161. Chương IX nvhoa102@gmail.com 19 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Hình dạng phức Ví dụ Tứ diện (sp3) Hình vuông phẳng (dsp2) cis-PtCl2(NH3)2
- 162. Chương IX nvhoa102@gmail.com 20 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Hình dạng phức Ví dụ Tháp tam giác (sp3d) Tháp hình vuông (dsp3) [Ni(CN)5]3- [CuCl5]3-
- 163. Chương IX nvhoa102@gmail.com 21 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Lăng trụ tam giác (d5s) Bát diện (sp3d2) Cr(CO)6 [W(CH3)6] Hình dạng phức Ví dụ
- 164. [Os(CN)7]3− Chương IX nvhoa102@gmail.com 22 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Tháp ngũ diện kép (d3sp3) Lăng trụ tam giác đơn chop (sp3d3) [ZrF7]3−
- 165. Chương IX nvhoa102@gmail.com 23 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Đối lăng trụ hình vuông (d4sp3) [TaF8]3- Lập phương (fsp3d3) 12 mặt tam giác (sp3d4)
- 166. Chương IX nvhoa102@gmail.com 24 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Lăng trụ tam giác tam chóp (sp3d5) Ba[ReH9] Giải thích sự tạo thành phức chất: [Co(NH3)6]3+ : phức bát diện, nghịch từ [Zn(NH3)4]2+ : phức tứ diện, nghịch từ [NiCl4]2- : phức tứ diện, thuận từ [Ni(CN)4]2- : phức hình vuông, nghịch từ
- 167. Chương IX nvhoa102@gmail.com 25 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP 2.2 Thuyết trường tinh thể Cơ sở: Tương tác tĩnh điện M : xét AO (bị L ảnh hưởng) L : tác động lên AO của M Xét obital (n-1)d của chất tạo phức: t2g eg
- 168. Chương IX nvhoa102@gmail.com 26 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP E AO Nguyên tử hoặc ion tự do E 0 EAO d trong đối xứng cầu 1/5E0 Tách mức năng lượng d z y x
- 169. Chương IX nvhoa102@gmail.com 27 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Phối trí bát diện: [Fe(CN)6]3-
- 170. Chương IX nvhoa102@gmail.com 28 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Phối trí tứ diện và Phối trí lập phương
- 171. Chương IX nvhoa102@gmail.com 29 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Phối trí hình vuông:
- 172. Chương IX nvhoa102@gmail.com 30 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Các yếu tố ảnh hưởng đến : - Điện tích hạt nhân của M (trong cùng phân nhóm) - Số oxi hóa của M - Điện trường của L: COCN->NO2 - > NH3>NCS- > H2O>C2O4 2->OH->F->SCN->Cl->Br->I- Mạnh Trung bình Yếu - Số phối trí - Sự phối trí
- 173. Chương IX nvhoa102@gmail.com 31 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP 1cm-1 = 11,96 J/mol 1eV = 96485 J/mol
- 174. Chương IX nvhoa102@gmail.com 32 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Cấu trúc electron hoá trị của ion chất tạo phức theo thuyết trường tinh thể: Xét chất tạo phức: AO tạo liên kết, số e tạo liên kết Xét số phối trí: - bát diện (n =6) - tứ diện (n=4) t2g eg t2g eg - Xét phức có mạnh hay yếu: sắp xếp e vào AO mới - L yếu (H2O, OH-, F-, Cl-…) : theo qui tắc Hund - L mạnh (CO, CN-, NO2 -…) xếp e xong ở AO thấp rồi mới lên AO cao
- 175. Chương IX nvhoa102@gmail.com 33 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Ví dụ: Xét cấu hình electron hóa trị của phức [CoF6]3- theo thuyết trường tinh thể. Co: 3d74s2 Co3+: 3d6 Số e- hóa trị là 6 Số phối tử 6 trường bát diện Phối tử là F- trường bát diện yếu: sắp xếp e- theo qui tắc Hund. t2g eg t2g eg
- 176. Chương IX nvhoa102@gmail.com 34 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Xét cấu hình electron hóa trị của các phức sau theo thuyết trường tinh thể: [Fe(H2O)6]3+ [Fe(CN)6]3- [Cr(CN)6]3- [Co(H2O)6]2+ [NiCl4]2- [Ni(CN)4]2- Zn(NH3)4]2+ [Cu(CN)3]2- [Ag(NH3)2]+
- 177. Chương IX nvhoa102@gmail.com 35 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Màu sắc của phức chất: d d = 2,48 eV Ion Ti3+ tự do Ion [Ti(H2O)6]3+ màu tím
- 178. Chương IX nvhoa102@gmail.com 36 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP 2.3 Thuyết orbital phân tử MO Cơ sở: Phức chất : thể thống nhất gồm M và L Khảo sát trên cơ sở cấu trúc electron của M và L Liên kết giữa M và L tạo thành do sự che phủ giữa các hóa trị hóa trị của chúng.
- 179. Chương IX nvhoa102@gmail.com 37 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Phức bát diện không có liên kết : [ML6]n+ nS np (n-1)d
- 180. Chương IX nvhoa102@gmail.com 38 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Phức bát diện không có liên kết MO [CoF6]3- MO [Co(NH3)6]3+ Co3+ Co3+ 6F- 6NH3
- 181. Chương IX nvhoa102@gmail.com 39 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP Phức bát diện có liên kết bổ sung: Điều kiện: Các AO t2g của Mn+ có tính đối xứng với các obital của L. Các obital của L có khả năng che phủ với AO t2g: AO p và d MO và *
- 182. Chương IX nvhoa102@gmail.com 40 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP khi obital của L có năng lượng cao hơn AO t2g của Mn+ tương tác cho M L x2-y2=z2 xy= xz = yz * x2-y2=* z2 * xy= * xz= * yz
- 183. Chương IX nvhoa102@gmail.com 41 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP khi obital của L có năng lượng thấp hơn AO d của Mn+ tương tác cho – nhận M L * xy= * xz= * yz x2-y2= z2 xy= xz = yz * x2-y2= * z2
- 184. Chương IX nvhoa102@gmail.com 42 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP 1.Gọi tên các phức chất sau: [Zn(OH)4]2- [Al(OH)4]- [CuCl2]- [AuCl4]- [Co(NH3)6]2+ [Fe(H2O)6]2+ [Ni(H2O)6]2+ [Fe(H2O)6]SO4 K4[FeF6] K3[Cr(OH)6] 2.Viết công thức các phức chất sau: Ion hexa xyano ferat (II) Hexa aquo crom (II) sunfat Kali hexa floro ferat (II) Kali hexa xiano ferat (III) Ion tetra hidroxo cuprat (II) Kali hexa hidroxo ferat (III) Natri tetra cloro cobanat (II) Hexa ammin niken (II) clorua
- 185. Chương IX nvhoa102@gmail.com 43 CHƯƠNG IX: CÁC NGUYÊN TỐ CHUYỂN TIẾP 3. Cho biết độ tan của AgI trong dung dịch NH3 1M. Biết Kb [Ag(NH3)2]+ = 108, TAgI = 8,3.10-17. 4. Xác định thế điện cực của Ag+/Ag khi cho NaCN vào dung dịch Ag(NO3)2 1M. Biết 0 Ag+/Ag = 0,8V và [Ag(CN)2]- = 7,8.1019. (ĐS: - 0,37 V) 5.Xét sự tạo thành phức theo thuyết trường tinh thể, MO [Cr(H2O)6]2+ [Fe(H2O)6]3+ [Cr(NH3)6]2+ [Fe(CN)6]4- [Co(CN)6]3- [Mn(CN)6]4- [MnF6]4- [FeCl4]2- Cho biết từ tính của phức?
- 186. Chương X nvhoa102@gmail.com 1 CHƯƠNG X: CÁC NGUYÊN TỐ PHÂN NHÓM VIIIB NỘI DUNG NHẬN XÉT CHUNG I. ĐƠN CHẤT Fe, Co, Ni II. HỢP CHẤT CỦA Fe, Co, Ni TÀI LIỆU [1] – Tập 3, Chương 7: trang 153 – 204 [2] – Chương 11: trang 233 – 246 [3] – Phần III, Chương 8: trang 538 – 572
- 187. Chương X nvhoa102@gmail.com 2 NHẬN XÉT CHUNG CHƯƠNG X: CÁC NGUYÊN TỐ PHÂN NHÓM VIIIB Nguyên tố Cấu hình e hóa trị RK (Å) Số oxi hóa Fe 3d64s2 1,26 (+6), +3, +2 Co 3d74s2 1,25 (+4), +3, +2 Ni 3d84s2 1,24 (+3), +2 Nguyên tố Cấu hình e hóa trị RK (Å) Số oxi hóa Ru 4d75s1 1,35 (+8), +4 Rh 4d85s1 1,34 (+6), +3 Pd 4d105s0 1,37 (+4), +2 Nguyên tố Cấu hình e hóa trị RK (Å) Số oxi hóa Os 5d66s2 1,35 (+8), +6 Ir 5d76s2 1,35 (+6), +4 Pt 5d96s1 1,35 (+6), +4, +2
- 188. Chương X nvhoa102@gmail.com 3 Cấu hình e hóa trị: (n-1)d6,7,8 ns2 - Quy luật biến đổi trạng thái oxi hóa dương cực đại: theo hàng ngang: ; theo cột dọc: - Dễ tạo hợp kim với nhau, với nguyên tố khác. - Các oxit, hydroxit có tính bazo yếu, axit yếu, lưỡng tính. - Dễ tạo phức với CO, NO, CN-. - Dễ hấp phụ H2 và hoạt hóa H2 hoạt tính xúc tác. CHƯƠNG X: CÁC NGUYÊN TỐ PHÂN NHÓM VIIIB
- 189. Chương X nvhoa102@gmail.com 4 I ĐƠN CHẤT Fe, Co, Ni 1 Tính chất vật lý - Màu trắng xám hoặc trắng bạc (Ni) - Dễ rèn, dát móng (trừ Co) - Có tính sắt từ: + Bị nam châm hút + dưới tác dụng của dòng điện nam châm - Hợp kim của Fe với C: Sắt mềm (<0,2%C); thép (0,2-1,7%C); gang (1,7-5%C) CHƯƠNG X: CÁC NGUYÊN TỐ PHÂN NHÓM VIIIB
- 190. Chương X nvhoa102@gmail.com 5 2 Tính chất hóa học - Hoạt tính hóa học trung bình: tính khử từ Fe Ni - Trạng thái khô, t0 thấp, dạng cục bền với KK - Khi đốt nóng, hoặc bột mịn: 3Fe + 2O2 Fe3O4 2Co + O2 2CoO 2Ni + O2 2NiO - Trạng thái ẩm, t0 cao bị ăn mòn 2Fe + 3/2O2 + H2O Fe2O3.nH2O (gỉ sắt) 1500C 3000C 5000C CHƯƠNG X: CÁC NGUYÊN TỐ PHÂN NHÓM VIIIB
- 191. Chương X nvhoa102@gmail.com 6 Fe2+ + 2OH- Fe(OH)2 4Fe(OH)2 + O2 + 2H2O 4Fe(OH)4 {Fe2O3.xH2O} CHƯƠNG X: CÁC NGUYÊN TỐ PHÂN NHÓM VIIIB
- 192. Chương X nvhoa102@gmail.com 7 - Phản ứng với axit HCl, H2SO4 loãng muối X2+ - Fe, Co, Ni bị thụ động với HNO3, H2SO4 đặc nguội 2Fe + 6H2SO4 đặc, nóng Fe2(SO4)3 + 3SO2 + 6H2O - Fe, Co, Ni không tác dụng với dung dịch kiềm. - Fe, Co, Ni tác dụng với CO tạo phức cacbonyl kim loại ứng dụng để tinh chế kim loại. Fe(tc) + 5CO Fe(CO)5 Fe(tk) + 5CO 230-330oC 100-200atm 150-200oC CHƯƠNG X: CÁC NGUYÊN TỐ PHÂN NHÓM VIIIB
- 193. Chương X nvhoa102@gmail.com 8 II HỢP CHẤT Fe, Co, Ni 1 Hợp chất (+2) 1.1 Fe (+2): Dạng đơn giản: FeO, Fe(OH)2, Fe2+. Dạng phức chất: [Fe(H2O)6]2+, [Fe(CN)6]4-, [Fe(NO)]2+ - FeO, Fe(OH)2 có tính bazơ > axit tan trong axit, không tan trong kiềm. - Fe (+2) có tính khử mạnh Fe (+3) FeO + O2 Fe2O3 2Fe(OH)2 + O2 + H2O 2Fe(OH)3 5Fe2+ + MnO4 ̅ + 8H3O+ 5Fe3+ + Mn2+ + 12H2O CHƯƠNG X: CÁC NGUYÊN TỐ PHÂN NHÓM VIIIB
- 194. Chương X nvhoa102@gmail.com 9 - Muối Mohr: (NH4)2Fe(SO4)2.6H2O - K4[Fe(CN)6].3H2O (muối vàng máu): thuốc thử của ion Fe3+: FeCl3 + K4[Fe(CN)6] KFe[Fe(CN)6] + 3KCl xanh beclin CHƯƠNG X: CÁC NGUYÊN TỐ PHÂN NHÓM VIIIB
- 195. Chương X nvhoa102@gmail.com 10 1.2 Co (+2): Dạng đơn giản: CoO, Co(OH)2, Co2+. Dạng phức chất: [Co(H2O)6]2+ , [Co(NH3)6]2+ , [CoCl4]2-… - CoO, Co(OH)2 có tính bazơ > axit tan trong axit, không tan trong kiềm, nước CoO + 2HCl CoCl2 + H2O CoO + 2HCl + 2 H2O [Co(H2O)6]Cl2 - Điều chế: Co2+ + 2OH- Co(OH)2 Co(OH)2 CoO + H2O t0 CHƯƠNG X: CÁC NGUYÊN TỐ PHÂN NHÓM VIIIB
- 196. Chương X nvhoa102@gmail.com 11 - CoO, Co(OH)2 có tính khử trung bình CoO + O2 Co3O4 4Co(OH)2 + O2 4CoO(OH) + 2H2O (chậm) - Tinh thể hydrat muối Co(+2) thay đổi màu sắc khi đốt nóng: 500 oC CoCl2.6H2O CoCl2.4H2O CoCl2.2H2O CoCl2.H2O CoCl2 hồng hồng tím xanh xanh da trời xanh da trời [Co(H2O)4Cl2] [Co(H2O)2Cl4] [CoCl6] to H2O ⇌ CHƯƠNG X: CÁC NGUYÊN TỐ PHÂN NHÓM VIIIB
- 197. Chương X nvhoa102@gmail.com 12 1.3 Ni (+2): Dạng đơn giản: NiO, Ni(OH)2, Ni2+. Dạng phức chất: [Ni(H2O)6]2+, [Ni(NH3)6]2+, [NiCl4]2-… - NiO, Ni(OH)2 có tính bazơ > axit tan trong axit, không tan trong kiềm, nước: NiO + 2HCl NiCl2 + H2O - Tính khử yếu: Ni(OH)2 + ½Br2 + KOH Ni(OH)3 + KBr - Ni (+2) dễ tạo thành phức amicat: NiCl2 + 6NH3(k) [Ni(NH3)6]Cl2 Ni(OH)2 dễ tan khi có mặt NH3 hoặc muối NH4 +: Ni(OH)2(r) + 6NH3(dd) [Ni(NH3)6](OH)2(dd) CHƯƠNG X: CÁC NGUYÊN TỐ PHÂN NHÓM VIIIB
- 198. Chương X nvhoa102@gmail.com 13 2 Hợp chất (+3) 2.1 Fe (+3): Dạng đơn giản: Fe2O3, Fe(OH)3, Fe3+. Dạng phức chất: [Fe(H2O)6]3+, [Fe(CN)6]3-, [FeCl4]- … - Fe2O3, Fe(OH)3: lưỡng tính (bazơ > axit) Fe2O3 + 6HCl + 6H2O 2[Fe(H2O)6]Cl3 Fe2O3 + 2KOHrắn 2KFeO2 + H2O Fe(OH)3 + 3HCl + 3H2O [Fe(H2O)6]Cl3 Fe(OH)3 + 3NaOHđđ Na3[Fe(OH)6] to tnc CHƯƠNG X: CÁC NGUYÊN TỐ PHÂN NHÓM VIIIB
- 199. Chương X nvhoa102@gmail.com 14 - Fe3+ bền, có tính oxi hóa yếu FeCl3 + 2KI 2FeCl2 + I2 + 2KCl - Muối Fe(+3) bị thủy phân: [Fe(H2O)6]3+ + H2O [Fe(H2O)5(OH)]2+ + H3O+ [Fe(H2O)5(OH)]2+ + H2O [Fe(H2O)4(OH)2]+ + H3O+ - K3[Fe(CN)6] (muối đỏ máu): thuốc thử cho ion Fe2+: FeCl2 + K3[Fe(CN)6] KFe[Fe(CN)6] + 2KCl Xanh tuabin CHƯƠNG X: CÁC NGUYÊN TỐ PHÂN NHÓM VIIIB
- 200. Chương X nvhoa102@gmail.com 15 2.2 Co (+3): - Hợp chất đơn giản Co(+3) không bền Tính oxi hóa mạnh Cho Co2O3, Co(OH)3 tác dụng với axit không tạo muối Co3+ mà tạo thành Co2+ 2Co2O3 + 4H2SO4 4CoSO4 + O2 + 4H2O 2Co(OH)3 + 6HCl 2CoCl2 + Cl2 + 6H2O CHƯƠNG X: CÁC NGUYÊN TỐ PHÂN NHÓM VIIIB
- 201. Chương X nvhoa102@gmail.com 16 2.3 Ni (+3): - Hợp chất Ni (+3) không đặc trưng, không bền Tính oxi hóa mạnh 2Ni(OH)3 + 6HCl 2NiCl2 + Cl2 + 6H2O QUY LUẬT BIẾN ĐỔI TÍNH CHẤT: Fe - Co – Ni: tính khử Fe(+2) – Co(+2) – Ni(+2): độ bền ; tính khử Fe(+3) – Co(+3) – Ni(+3): độ bền ; tính oxihóa CHƯƠNG X: CÁC NGUYÊN TỐ PHÂN NHÓM VIIIB
- 202. Chương XI nvhoa102@gmail.com 1 CHƯƠNG XI: CÁC NGUYÊN TỐ PHÂN NHÓM VIIB NỘI DUNG NHẬN XÉT CHUNG I. ĐƠN CHẤT Mn II.HỢP CHẤT CỦA Mn TÀI LIỆU [1] – Tập 3, Chương 6: trang 121 – 144 [2] – Chương 12: trang 247 – 255 [3] – Phần III, Chương 7: trang 515 – 527
- 203. Chương XI nvhoa102@gmail.com 2 NHẬN XÉT CHUNG - Cấu hình e hóa trị giống nhau: (n1)d5ns2, nên: X –ne → X (+2,…, +7) thể hiện tính kim loại. - Số oxi hóa dương đặc trưng, bền: +7. Riêng Mn còn có các số oxi hóa đặc trưng và bền là +2, +4. - Ở số oxi hóa dương thấp chúng giống kim loại như Fe, Cr … - Ở số oxi hóa dương cao có tính chất giống phi kim như clo. CHƯƠNG XI: CÁC NGUYÊN TỐ PHÂN NHÓM VIIB
- 204. Chương XI nvhoa102@gmail.com 3 I ĐƠN CHẤT Mn 1 Tính chất vật lý - Màu trắng bạc, bề ngoài giống sắt nhưng cứng, dòn hơn. - Độ cứng: 5 – 6 (> Fe, Ni, Cr); Độ dẫn điện = 5 - Khó nóng chảy và khó sôi - Tạo hợp kim với nhiều kim loại. Thép đường rây chứa 1 – 2%Mn, thép bi nghiền hoặc má ngàm chứa 10 – 15%Mn … CHƯƠNG XI: CÁC NGUYÊN TỐ PHÂN NHÓM VIIB
- 205. Chương XI nvhoa102@gmail.com 4 2 Tính chất hóa học - Mn là kim loại tương đối hoạt động 3Mn + 2O2 Mn3O4 Mn bột mịn + 2H2O Mn(OH)2 + H2 Mn + H2SO4 MnSO4 + H2 Mn + Cl2 MnCl2 3 Điều chế từ quặng pyroluzit MnO2.nH2O 3MnO2 Mn3O4 + O2 3Mn3O4 + 8Al 9Mn + 4Al2O3 (E 2+ o Mn /Mn = -1,185 V) t0 t0 t0 CHƯƠNG XI: CÁC NGUYÊN TỐ PHÂN NHÓM VIIB
- 206. Chương XI nvhoa102@gmail.com 5 II HỢP CHẤT Mn 1 Hợp chất Mn (+2): MnO, Mn(OH)2, Mn2+ - MnO, Mn(OH)2 có tính bazo > axit MnO + 2HCl MnCl2 + H2O Mn(OH)2 + H2SO4 MnSO4 + H2O CHƯƠNG XI: CÁC NGUYÊN TỐ PHÂN NHÓM VIIB
- 207. Chương XI nvhoa102@gmail.com 6 - Hợp chất Mn(+2) có tính khử đặc trưng: • Trong môi trường kiềm Mn(+4) 2Mn(OH)2 + O2 + 2H2O Mn(OH)4 • Trong môi trường kiềm nóng chảy MnO4 2- 3MnSO4 + 2KClO3 + 12KOH 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O • Trong môi trường axit MnO4 - 3MnSO4 + 5PbO2 + 6HNO3 2HMnO4 + 3Pb(NO3)2 + 2PbSO4 + 2H2O CHƯƠNG XI: CÁC NGUYÊN TỐ PHÂN NHÓM VIIB
- 208. Chương XI nvhoa102@gmail.com 7 2 Hợp chất Mn (+4): MnO2, Mn(OH)4 - Mn4+ không bền - MnO2, Mn(OH)4 không tan, có tính lưỡng tính nhưng cả 2 tính đều yếu. MnO2 + 4HCl đặc MnCl2 + Cl2 + 2H2O MnO2 + 2KOH K2MnO3 + H2O - Tính oxi hóa: 2Mn(OH)4 + 2H2SO4 2MnSO4 + O2 + 6H2O - Tính khử khi tác dụng với chất oxi hóa mạnh: MnO2 Mn(OH)4 CHƯƠNG XI: CÁC NGUYÊN TỐ PHÂN NHÓM VIIB
- 209. Chương XI nvhoa102@gmail.com 8 • Trong môi trường kiềm rắn nóng chảy 2MnO2 + KClO3 + 6KOH 3K2MnO4 + KCl + 3H2O • Trong môi trường axit: 2MnO2 + 3PbO2 + 6HNO3 2HMnO4 + 3Pb(NO3)2 + 2H2O 3 Hợp chất Mn (+6) - Muối MnO4 2- có màu lục thẫm, không bền bị phân hủy trong nước 3K2MnO4 + 2H2O 2KMnO4 + MnO2 + 4KOH CHƯƠNG XI: CÁC NGUYÊN TỐ PHÂN NHÓM VIIB
- 210. Chương XI nvhoa102@gmail.com 9 - MnO4 2- có tính oxi hóa mạnh: • Trong môi trường kiềm: MnO2 K2MnO4 + K2SO3 + H2O MnO2 + K2SO4 + 2KOH • Trong môi trường axit Mn2+ K2MnO4 + K2SO3 + H2SO4 K2SO4 + MnSO4 + H2O - MnO4 2- thể hiện tính khử khi tác dụng với chất oxihóa mạnh. 2K2MnO4 + Cl2 2KMnO4 + 2KCl CHƯƠNG XI: CÁC NGUYÊN TỐ PHÂN NHÓM VIIB
- 211. Chương XI nvhoa102@gmail.com 10 4 Hợp chất Mn (+7) - HMnO4 tồn tại ở dạng dung dịch C < 20%, nếu C > 20% bị phân hủy: 2HMnO4 2MnO2 + 3/2O2 + H2O - Muối MnO4 - màu tím đen, bền hơn MnO4 2- - Muối MnO4 - bị nhiệt phân ở khoảng 250oC: 2KMnO4 K2MnO4 + MnO2 + O2 - Bị phân huỷ trong kiềm đặc: 4KMnO4 + 4KOH 4K2MnO4 + O2 + 2H2O CHƯƠNG XI: CÁC NGUYÊN TỐ PHÂN NHÓM VIIB
- 212. Chương XI nvhoa102@gmail.com 11 - Có tính oxi hóa mạnh, sản phẩm tạo thành phụ thuộc vào môi trường: • Trong môi trường axit Mn2+ 5K2SO3 + 2KMnO4 + 3H2SO4 6K2SO4 + 2MnSO4 + 3H2O • Trong môi trường trung tính MnO2 3K2SO3 + 2KMnO4 + H2O 3K2SO4 + 2MnO2 + 2KOH • Trong môi trường bazơ MnO4 2- K2SO3 + 2KMnO4 + 2KOH K2SO4 + 2K2MnO4 + H2O CHƯƠNG XI: CÁC NGUYÊN TỐ PHÂN NHÓM VIIB
- 213. Chương XI nvhoa102@gmail.com 12 Điều chế KMnO4 - Oxihóa MnO4 2- bằng Cl2 hay PbO2 – HNO3 2K2MnO4 + Cl2 2KMnO4 + 2KCl 2K2MnO4 + 2PbO2 + 6HNO3 2KMnO4 + 2Pb(NO3)2 + 2KNO3 + 3H2O - Điện phân dung dịch MnO4 2- 2K2MnO4 + 2H2O 2KMnO4 + 2KOH + H2 dòng điện CHƯƠNG XI: CÁC NGUYÊN TỐ PHÂN NHÓM VIIB
- 214. Chương XIII nvhoa102@gmail.com 1 CHƯƠNG XIII: CÁC NGUYÊN TỐ PHÂN NHÓM IIB NỘI DUNG NHẬN XÉT CHUNG I. ĐƠN CHẤT II. HỢP CHẤT TÀI LIỆU [1] – Tập 3, Chương 10: trang 253 – 272 [2] – Chương 15: trang 275 – 281 [3] – Phần III, Chương 2: trang 395 – 410
- 215. Chương XIII nvhoa102@gmail.com 2 NHẬN XÉT CHUNG Nguyên tố Cấu hình R ( Å) I2, eV I3, eV E0 M2+/M, V Zn 4s23d10 1,39 17,96 (Ca: 11,87) 39,90 - 0,76 Cd 5s24d10 1,56 16,90 (Sr: 11,03) 37,47 - 0,40 Hg 6s24f145d10 1,60 18,75 (Ba: 10,00) 32,43 + 0,85 - e hoá trị nS → chỉ tạo các hợp chất +1 (Hg2 2+), +2 - Kém hoạt động hơn so với kim loại IIA - Kim loại và hợp chất của nó đều độc. CHƯƠNG XIII: CÁC NGUYÊN TỐ PHÂN NHÓM IIB
- 216. Chương XIII nvhoa102@gmail.com 3 I ĐƠN CHẤT 1 Tính chất vật lý - Kim loại trắng bạc, bị mất màu và ánh kim trong không khí, dễ nóng chảy, bay hơi. Nguyên tố Zn Cd Hg T0 nc 0C 419,6 321 - 38,86 T0 s 0C 906 767 356,66 - Tạo hợp kim với nhau và với nhiều kim loại khác CHƯƠNG XIII: CÁC NGUYÊN TỐ PHÂN NHÓM IIB
- 217. Chương XIII nvhoa102@gmail.com 4 2 Tính chất hóa học - Tính khử giảm từ Zn đến Hg. Đối với HCl, H2SO4 loãng: Zn tan dễ dàng, Cd tan chậm, Hg không tan - Đối với HNO3: đều dễ tan 6Hg + 8HNO3loãng 3Hg2(NO3)2 + 2NO + 4H2O Hg + 4HNO3đặc Hg(NO3)2 + 2NO2 + 2H2O - Zn là kim loại lưỡng tính: Zn + 2HCl + 4H2O H2 + [Zn(H2O)4]Cl2 Zn + 2NaOH + 2H2O H2 + Na2[Zn(OH)4] E E E2+ 2+ 2+ o o o Zn / Zn Cd /Cd Hg /Hg = -0,76 V; = -0,40 V; = +0,85 V CHƯƠNG XIII: CÁC NGUYÊN TỐ PHÂN NHÓM IIB
- 218. Chương XIII nvhoa102@gmail.com 5 II HỢP CHẤT 1 Oxit - ZnO, CdO rất bền nhiệt, HgO kém bền nhiệt 2HgO 2Hg + O2 (4000 C) - Các XO không tan trong nước, có tính lưỡng tính hoạt bazo ZnO + 2NaOHđặc + H2O Na2[Zn(OH)4] CdO + NaOHrắn, nóng chảy Na2CdO2 + H2O HgO + 2HNO3 Hg(NO3)2 + H2O CHƯƠNG XIII: CÁC NGUYÊN TỐ PHÂN NHÓM IIB
- 219. Chương XIII nvhoa102@gmail.com 6 2 Hydroxit - Zn(OH)2 có tính lưỡng tính điển hình - Cd(OH)2 có tính bazo - Hg(OH)2 không tồn tại vì bị mất nước ngay khi tạo thành: Hg2+ + 2OH- HgO + H2O 3 Muối và phức chất - Hg2+ có tính oxy hóa Hg(NO3)2 + Hg Hg2(NO3)2 HgCl2 + SO2 + 2H2O Hg + H2SO4 + 2HCl CHƯƠNG XIII: CÁC NGUYÊN TỐ PHÂN NHÓM IIB
- 220. Chương XIII nvhoa102@gmail.com 7 - Dễ tạo phức cation aquơ, amicat, halogeno, cyano… với số phối trí đặc trưng 4 4 Hợp chất Hg (+1) - Trạng thái Hg(+1) tồn tại trong Hg2(NO3)2; Hg2Cl2 - Không có ion Hg+ mà có ion Hg2 2+ với cấu trúc [-Hg-Hg-]2+ - Hg (+1) thể hiện tính oxi hóa và khử Hg2Cl2 + SO2 + H2O → 2Hg + H2SO4 + 2HCl 3Hg2Cl2 + 8HNO3 → 3HgCl2 + 3Hg(NO3)2 + 2NO + 4H2O CHƯƠNG XIII: CÁC NGUYÊN TỐ PHÂN NHÓM IIB
- 221. Chương XIV nvhoa102@gmail.com 1 CHƯƠNG XIV: CÁC NGUYÊN TỐ PHÂN NHÓM IB
- 222. Chương XIV nvhoa102@gmail.com 2 CHƯƠNG XIV: CÁC NGUYÊN TỐ PHÂN NHÓM IB NỘI DUNG NHẬN XÉT CHUNG I. ĐƠN CHẤT 1. Tính chất vật lý 2. Tính chất hóa học II. HỢP CHẤT 1. Các hợp chất +1 2. Các hợp chất +2 3. Các hợp chất +3 TÀI LIỆU [1] – Tập 3, Chương 9: trang 226 – 252 [2] – Chương 16: trang 282 – 291 [3] – Phần III, Chương 1: trang 374 – 394
- 223. Chương XIV nvhoa102@gmail.com 3 NHẬN XÉT CHUNG - Cấu hình electron của 2 lớp ngoài cùng: (n-1)s2 (n-1)p6 (n-1)d10 ns1 Gây ra hiệu ứng chắn kém hơn cấu hình (n-1)s2(n-1)p6 mức độ hoạt động IB < IA Kém bền hơn cấu hình (n-1)s2 (n-1)p6 tạo các hợp chất có số OXH > +1 CHƯƠNG XIV: CÁC NGUYÊN TỐ PHÂN NHÓM IB
- 224. Chương XIV nvhoa102@gmail.com 4 IB Cu Ag Au Rk,(Å) 1,28 1,44 1,44 I1, (eV) 7,72 7,57 9,22 I2, (eV) 20,29 21,50 20,50 I3, (eV) 36,9 34,82 30,50 IA K Rb Cs Rk,(Å) 2,36 2,53 2,74 I1, (eV) 4,32 4,16 3,58 Cu Au: tính KL , khả năng tạo phức , các hợp chất số OXH cao đều có màu, hợp chất tan đều độc. CHƯƠNG XIV: CÁC NGUYÊN TỐ PHÂN NHÓM IB
- 225. Chương XIV nvhoa102@gmail.com 5 I ĐƠN CHẤT 1 Tính chất vật lý - Dễ tạo hợp kim với nhau và với kim loại khác - Dễ tạo hỗn hóng với Hg - Rất dễ kéo sợi, dát mỏng (nhất là Au). CHƯƠNG XIV: CÁC NGUYÊN TỐ PHÂN NHÓM IB Kim loại To nc, oC To s, oC Tỷ khối Độ cứng (thang Mohr) Độ dẫn điện (Hg = 1) Độ dẫn nhiệt (Hg = 1) Cu 1083 2543 8,94 3,0 57 36 Ag 960,6 2167 10,50 2,7 59 49 Au 1073,4 2880 19,32 2,5 40 35
- 226. Chương XIV nvhoa102@gmail.com 6 2 Tính chất hóa học - Kim loại kém hoạt động và hoạt tính Cu Au: + Tác dụng với oxi không khí 2Cu + O2 + 2H2O 2Cu(OH)2 Cu(OH)2 + Cu Cu2O + H2O nếu không khí có H2S: 4Ag + 2H2S + O2 2Ag2S + 2H2O CHƯƠNG XIV: CÁC NGUYÊN TỐ PHÂN NHÓM IB t0 thường
- 227. Chương XIV nvhoa102@gmail.com 7 Tác dụng với axit: + Cu tác dụng với axit HCl, H2SO4 loãng có O2kk Cu + H2SO4loãng + 1/2O2kk CuSO4 + H2O + Cu, Ag tác dụng với axit HI, H2SO4đđ, HNO3 Cu + HI CuI + 1/2H2 3Ag + 4HNO3loãng 3AgNO3 + NO + 2H2O + Cu, Ag, Au tác dụng với nước cường thủy, dd HCl bão hòa clo, dd CN- trong không khí, HCN đậm đặc Au + HNO3 + 4HCl H[AuCl4] + NO + 2H2O 2Au + 3Cl2 + 2HCl 2H[AuCl4] 4Au + 8KCN + 2H2O + O2 4K[Au(CN)2] + 4KOH CHƯƠNG XIV: CÁC NGUYÊN TỐ PHÂN NHÓM IB
- 228. Chương XIV nvhoa102@gmail.com 8 II HỢP CHẤT 1 Các hợp chất (+1) Các oxyt E2O: đều là chất rắn, ít tan trong nước, tan một phần trong dd kiềm đặc. Cu2O + 2NaOHđặc 2Na[Cu(OH)2] - Cu2O và Ag2O tan trong dd NH3đđ : Cu2O + 4NH3 + H2O 2[Cu(NH3)2]OH Ag2O + 4NH3 + H2O 2[Ag(NH3)2]OH - Cu2O bền nhiệt, Ag2O và Au2O kém bền nhiệt CHƯƠNG XIV: CÁC NGUYÊN TỐ PHÂN NHÓM IB
- 229. Chương XIV nvhoa102@gmail.com 9 Điều chế oxyt E2O: 2CuSO4 + 4NaOH + C6H12O6 Cu2O + C6H12O7 + 2H2O + 2Na2SO4 2AgNO3 + 2NaOH Ag2O + 2NaNO3 + H2O 2AuCl + 2KOH Au2O + 2KCl + H2O Các hydroxit EOH: đều kém bền 2EOH E2O + H2O CHƯƠNG XIV: CÁC NGUYÊN TỐ PHÂN NHÓM IB
- 230. Chương XIV nvhoa102@gmail.com 10 Các muối Cu(+1), Au(+1): không tan trong nước, ở trạng thái ẩm không bền bị phân hủy, tan trong HClđặc 2CuCl (r) CuCl2 + Cu (r) 3AuCl (r) AuCl3 + 2 Au (r) Các muối Ag(+1): bền trong dung dịch. Bị phân hủy dưới tác dụng ánh sáng với mức độ khác nhau: 2AgBr 2Ag + Br2 các halogenua dễ bị phân cực hóa bởi Ag+ CHƯƠNG XIV: CÁC NGUYÊN TỐ PHÂN NHÓM IB
- 231. Chương XIV nvhoa102@gmail.com 11 Phức chất của E(+1): - phức cation amiacat rất bền CuCl + 2NH3 [Cu(NH3)2]Cl Ag2O + 4NH3 + H2O 2[Ag(NH3)2]OH - phức anion phổ biến hơn và bền CuCl + HCl H[CuCl2] AgBr + 2Na2S2O3 Na3[Ag(S2O3)2] + NaBr CHƯƠNG XIV: CÁC NGUYÊN TỐ PHÂN NHÓM IB
- 232. Chương XIV nvhoa102@gmail.com 12 2 Các hợp chất (+2) – Cu(+2) CuO: - Tạo thành khi đốt nóng Cu với không khí hoặc nhiệt phân Cu(OH)2. - Không tan trong nước, dễ tan trong axit, tan trong dd NH3 tạo phức amiacat, phân hủy khi đun nóng CuO + 4NH3 + H2O [Cu(NH3)4](OH)2 4CuO 2Cu2O + O2 (11000C) CHƯƠNG XIV: CÁC NGUYÊN TỐ PHÂN NHÓM IB
- 233. Chương XIV nvhoa102@gmail.com 13 - bị SnCl2, FeCl2 khử về Cu(+1) khi đun nóng 2CuO + SnCl2 2CuCl + SnO2 3CuO + 2FeCl2 2CuCl + CuCl2 + Fe2O3 - bị H2, CO, C, NH3, Al khử về kim loại khi đốt nóng CuO + CO Cu + CO2 3CuO + 2NH3 k 3Cu + N2 + 3H2O Hydroxit Cu(OH)2: - không tan trong nước, dễ tan trong axit và dd NH3 Cu(OH)2 + 4NH3 [Cu(NH3)4](OH)2 CHƯƠNG XIV: CÁC NGUYÊN TỐ PHÂN NHÓM IB
- 234. Chương XIV nvhoa102@gmail.com 14 - có tính lưỡng tính Cu(OH)2 + 2NaOHđặc,dư Na2[Cu(OH)4] + 2H2O Muối Cu(+2): dễ tan, bị thủy phâm, dễ tạo phức như [Cu(H2O)6]2+ ; [Cu(NH3)4]2+ ; [Cu(CN)4]2- ; [CuCl4]2- … 2CuSO4 + 4NaI 2CuI + I2 + 2Na2SO4 * Nước Suâyze: thành phần, tính chất, ứng dụng Nước Fehling: thành phần, tính chất, ứng dụng CHƯƠNG XIV: CÁC NGUYÊN TỐ PHÂN NHÓM IB
- 235. Chương XIV nvhoa102@gmail.com 15 CHƯƠNG XIV: CÁC NGUYÊN TỐ PHÂN NHÓM IB 3 Các hợp chất (+3) – Au(+3) Au2O3: - Không tan trong nước, bị phân hủy ở 1600C Au2O3 Au + O2 (160 – 2900C) - Có tính lưỡng tính Au2O3 + 8HClđặc 2H[AuCl4] + 3H2O Au2O3 + 2NaOHđặc,nóng + 3H2O 2Na[Au(OH)4]
- 236. Chương XIV nvhoa102@gmail.com 16 CHƯƠNG XIV: CÁC NGUYÊN TỐ PHÂN NHÓM IB Au(OH)3: - Không tan trong nước, thể hiện tính axit trội hơn tính bazo Au(OH)3 + NaOH Na[Au(OH)4] Au(OH)3 + 2H2SO4 H[Au(SO4)2] + 3H2O 2Au(OH)3 Au2O3 + 3H2O (1000C)
- 237. Chương XIV nvhoa102@gmail.com 17 CHƯƠNG XIV: CÁC NGUYÊN TỐ PHÂN NHÓM IB Muối Au(+3): - Kém bền nhiệt: AuCl3 AuCl + Cl2 (150-1850C) 2AuCl 2Au + Cl2 (trên 2890C) - Tính oxi hóa mạnh: 2AuCl3 + 3H2O2 2Au + 3O2 + 6HCl - Dễ tạo phức: AuCl3 + NaCl Na[AuCl4]
